Tire todas as suas dúvidas sobre Troca de Calor em mais uma aula de Física Enem. Estude conosco para o Exame Nacional do Ensino Médio
O princípio geral das trocas de calor
Nesta aula vamos, mais uma vez, aplicar o princípio geral das trocas de calor:
|
Q1 + Q2 + Q3 + Q4 + … + Qn = 0 |
Desta vez realizaremos trocas de calor que provocarão variações de temperaturas e também mudanças de estado físico.
Dica 1 – O calor é transferido espontaneamente de um corpo “mais quente” para o “mais frio”. Estude com a Aula 1 de Princípio Geral da Troca de Calor e fique preparado para prova de Física Enem – https://blogdoenem.com.br/principio-geral-da-troca-de-calor/
Já sabemos que o calor que provoca variação de temperatura é denominado calor sensível e calculado pela expressão:
|
Q = m ⋅ c ⋅Δθ |
Sabemos também que o calor que provoca mudança de estado físico é chamado calor latente e calculado por:
|
Q = m ⋅ L |
É importante ressaltar que nas mudanças de estado físico que exigem um recebimento de calor (a sublimação, a fusão e a vaporização) a quantidade de calor Q é positiva (calor recebido). Por outro lado, nas mudanças de estado físico que exigem uma perda de calor (a sublimação inversa, a solidificação e a condensação) a quantidade de calor Q é negativa (calor perdido).
Assim, podemos dizer, por exemplo: Lfusão do gelo = 80 cal/g, Lsolidificação da água = – 80 cal/g, Lvaporização da água = 540 cal/g e Lcondensação da água = – 540 cal/g.
Dica 2 – Relembre sobre Calor sensível e Calor latente nesta aula de Física Enem. Estude conosco e fique preparado para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/calor-sensivel-e-calor-latente-revisao-de-fisica-enem/
Aplicação numérica
Em um recipiente termicamente isolado e de capacidade térmica desprezível que contém 500 g de água a 80 °C é colocado um bloco de gelo em fusão a 0 °C.
São dados: cágua = 1 cal/(g·ºC) e Lfusão do gelo = 80 cal/g.
Se o equilíbrio térmico da mistura é alcançado a 20 °C, qual é a massa m do bloco de gelo?
Resolução
Vamos esboçar a curva de aquecimento e de resfriamento dos corpos.
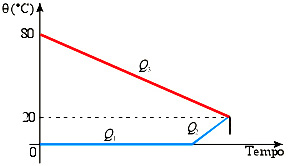
Devemos observar que, durante a troca de calor, o bloco de gelo sofrerá fusão completa ao receber a quantidade de calor Q1 e a água resultante da fusão desse gelo, a 0 °C, será aquecida até 20 °C, a temperatura final de equilíbrio, ao receber a quantidade de calor Q2. Enquanto isso, a água, inicialmente a 80 °C, apenas será resfriada a 20 °C, ao perder a quantidade de calor Q3.
Então, do princípio geral das trocas de calor, temos:
Q1 + Q2 + Q3 = 0
Substituindo as grandezas conhecidas, obtemos:
m · 80 + m · 1 · (20 – 0) + 500 · 1 · (20 – 80) = 0→
m · 80 + m · 20 ˗ 30000 = 0→
m · 100 = 30000→
m = 300 g
Saiba mais sobre Troca de Calor nestas duas aulas do nosso canal Curso Enem Gratuito, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios
Questão 1
(UECE) Uma garrafa térmica, de capacidade térmica desprezível, contém 980 g de água à temperatura de 28 ºC. Para refrigerar a água, são introduzidos na garrafa cubos de gelo de 25 g cada, a 0 ºC, e a seguir a tampa é fechada. Considere que o calor latente de fusão do gelo é 80 cal/g e o calor específico da água é 1,0 cal/(g·ºC). Quantos cubos de gelo devem ser introduzidos na garrafa, para se obter água a 18 ºC?
a) 5
b) 4
c) 3
d) 2
Dica 3 – Nesta aula de Física Enem vamos estudar sobre a Dilatação Térmica dos Líquidos e saber por que a água, ao ser aquecida, não reage como os outros líquidos – https://blogdoenem.com.br/dilatacao-termica-dos-liquidos-fisica-enem/
Questão 2
(Mack–SP) Para certo procedimento industrial, necessita-se de água a 20 °C, mas só se dispõe de água no estado sólido a 0 °C (gelo) e água fervente a 100 °C. Considere o calor latente de fusão da água igual a 80 cal/g e o calor específico da água igual a 1 cal/(g·°C). A relação entre a massa de gelo e a massa de água fervendo que se deve misturar em um recipiente adiabático, para a obtenção do desejado, é:
a) 4/5
b) 3/4
c) 2/3
d) 1/2
e) 1/3
Questão 3
(UFG) A temperatura típica de uma tarde quente em Aruanã, cidade do estado de Goiás, situada às margens do rio Araguaia, é de 37 °C. Os banhistas, nas areias do rio Araguaia, usam cubos de gelo para resfriar um refrigerante que se encontra à temperatura ambiente. Em um recipiente de isopor (isolante térmico de capacidade térmica desprezível) são adicionados 300 mL do refrigerante. Considere que o calor específico e a densidade de massa do refrigerante sejam iguais aos da água. Adote: calor latente de fusão da água igual a 80 cal/g e calor específico da água igual a 1 cal/(g·°C). Calcule qual deve ser a mínima quantidade de gelo a ser adicionada ao refrigerante para reduzir sua temperatura a 12 °C.
a) 150,0 g
b) 125,5 g
c) 81,5 g
d) 74,5 g
e) 63,5 g
Questão 4
(UEL – PR) Um recipiente de capacidade térmica 50 cal/ºC contém 200 g de água a 40 ºC. Introduz-se no recipiente 50 g de gelo a 0 ºC. Admitindo que não há trocas de calor com o ambiente, a temperatura final de equilíbrio, em ºC, é:
a) 24
b) 20
c) 15
d) 12
e) zero
Dados: calor específico da água = 1 cal/(g·ºC); calor latente de fusão do gelo = 80 cal/g
Questão 5
(PUCCamp – SP) Um forno aquecido a carvão atinge a temperatura θ. Uma peça de aço de massa 400 g é retirada do forno a essa temperatura e introduzida, juntamente com 40 g de gelo a −20 °C, em um calorímetro de cobre de capacidade térmica 40 cal/°C que está à temperatura de 20 °C. O equilíbrio térmico é estabelecido a 80 °C. Nestas condições, a temperatura θ do forno, em °C, vale:
Dados:
Calor específico da água = 1,0 cal/(g·°C)
Calor específico do gelo = 0,50 cal/(g·°C)
Calor específico do aço = 0,10 cal/(g·°C)
Calor latente de fusão do gelo = 80 cal/g
a) 270
b) 290
c) 310
d) 330
e) 350
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
