É para gabaritar em Química Enem: entenda como relacionar as propriedades químicas e físicas dos elementos dentro da Tabela Periódica. Você pode conhecer as famílias e dominar as características comuns. Veja no resumo com aula gratuita.
As Propriedades Periódicas dos Elementos Químicos – Faça a sua revisão online para dominar o essencial da Tabela Periódica de Mendelev. É básico.
Como a tabela periódica foi elaborada com base nas propriedades periódicas (químicas e físicas) dos elementos, analisando-a, podemos obter informações sobre eles, chegando-se assim a propriedades importantes.
As propriedades podem ser divididas em periódicas (são as que se repetem de períodos em períodos) e aperiódicas (não se repetem de período em período). 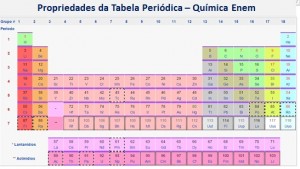 A Tabela Periódica ajuda você a entender os fundamentos utilizados para a classificação dos Elementos Químicos.
A Tabela Periódica ajuda você a entender os fundamentos utilizados para a classificação dos Elementos Químicos.
Entenda o Raio atômico
É a medida do tamanho do átomo. É a distancia do núcleo até o elétron mais externo da ultima camada. Numa família o raio cresce de cima para baixo porque há um aumento no numero de camadas ocupadas por elétrons.
Num período o raio atômico cresce da direita para a esquerda, pois átomos situados mais a esquerda da tabela possuem carga nuclear maior.
Isto se reflete na posição do elemento químico na Tabela Periódica.  Mais uma vez estamos demonstrando que a Tabela reflete as Propriedades Periódicas dos Elementos.
Mais uma vez estamos demonstrando que a Tabela reflete as Propriedades Periódicas dos Elementos.
A Energia de ionização
É a quantidade de energia fornecida a um átomo isolado no estado gasoso para retirar um elétron, formando um íon gasoso positivo. 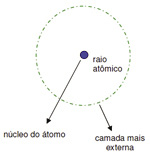
Resumo sobre a Tabela Periódica
Confira uma aula gratuita com o professor Sobis. Ele explica de maneira bem didática como você pode utilizar a Tabela Periódica para mandar bem nas provas.
Muito bom este resumo. Agora, vamos continuar.
Exemplo de Energia de Ionização:
Se tivermos um mol de átomos de sódio no estado gasoso e fornecermos ao sistema 119 quilocalorias (kcal), cada átomo de sódio vai perder um elétron. Assim 119Kcal/mol é o potencial de ionização do sódio. ![]() Na(g) + 119 kcal/mol → Na+(g) + e-
Na(g) + 119 kcal/mol → Na+(g) + e-
Dica: Os elétrons retirados são sempre os da camada de valência.
A sua variação na tabela periódica ocorre da seguinte maneira: 
Eletroafinidade
É a energia liberada por um átomo isolado no estado gasoso ao receber um elétron, formando um íon negativo. ![]() Exemplo: Cℓ(g) + 1e- → Cℓ–(g) + 83,3 kcal/mol
Exemplo: Cℓ(g) + 1e- → Cℓ–(g) + 83,3 kcal/mol 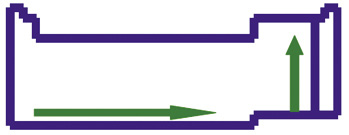 Observe nas setas verdes que a Eletroafinidade é crescente da esquerda para a direita na Tabela Periódica, e ascendente da base para o topo da tabela.
Observe nas setas verdes que a Eletroafinidade é crescente da esquerda para a direita na Tabela Periódica, e ascendente da base para o topo da tabela.
Eletronegatividade e o Diagrama de Linus Pauling
É a propriedade periódica na qual o átomo apresenta a maior ou menor tendência em atrair elétrons para si, resultando numa ação conjunta da energia de ionização e da eletroafinidade.
Linus Pauling estabeleceu uma escala de valores para a eletronegatividade, atribuindo ao elemento flúor o maior valor.  O elemento mais eletronegativo é o flúor, os gases nobre não possuem essa propriedade pois não precisam ganhar nem perder elétrons para ficarem estáveis.
O elemento mais eletronegativo é o flúor, os gases nobre não possuem essa propriedade pois não precisam ganhar nem perder elétrons para ficarem estáveis.
Continue estudando com o Curso Enem Gratuito
Eletropositividade
É a oposição da eletronegatividade. Os átomos eletropositivos tendem a doar elétrons, propriedade marcante dos metais. Na tabela periódica ela cresce da direita para a esquerda e nos períodos, e de baixo para cima nas famílias.
O elemento mais eletropositivo é o Frâncio (Fr). 
Observação Importante: Há uma relação entre todas as propriedades periódicas mostradas acima. Temos átomos com grande tendência a ganhar elétrons como também a perder elétrons.
Esses fenômenos dependem essencialmente de uma dessas propriedades, o raio atômico. Observe o esquema a seguir: 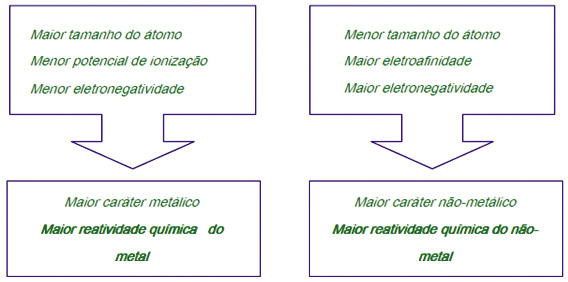
Dica 3 – Sabe tudo sobre os tipos de matéria, fenômenos físicos e químicos? Relembre com esta aula de Química e garanta sua nota no próximo Enem! – https://blogdoenem.com.br/quimica-enem-propriedades-materia/
Exercícios – Desafios para você responder e compartilhar
Questão 01
(PEIES 1 – UFSM – 2006) “Os vidros borossilicatados são obtidos pela adição de óxido de alumínio e óxido de boro à sílica e podem suportar o aquecimento e posterior resfriamento sem trincar.”
Em relação aos elementos neutros boro e oxigênio, pode-se afirmar que o raio atômico do elemento boro é _________ que o raio atômico do oxigênio, pois o oxigênio tem _________ número de elétrons na camada de valência, _______ a carga nuclear efetiva e ________ o raio atômico.
a) menor – menor – diminuindo – aumentando.
b) maior – maior – aumentando – diminuindo.
c) maior – maior – diminuindo – aumentando.
d) maior – menor – aumentando – diminuindo.
e) menor –maior – diminuindo – aumentando.
Questão 02
(Vestibular UFSM – 2011) “Zinco, selênio, ferro e fósforo são sais minerais que participam de inúmeras trocas elétricas e mantêm o cérebro acordado e ativo. Estão presentes em sementes e grãos, raízes e folhas verde-escuras.”
Em relação aos elementos oxigênio, fósforo e selênio, assinale verdadeiro (V) ou falsa (F) em cada uma das afirmativas.
( ) o raio atômico do oxigênio é menor que o do selênio, pois o primeiro tem menor número de camadas eletrônicas.
( ) o oxigênio perde elétrons com mais facilidade que o selênio.
( ) o oxigênio é mais eletronegativo que o fósforo.
A seqüência correta é
a) F-V-F.
b) V-F-V.
c) F-F-V.
d) V-F-F.
e) V-V-F.
Questão 03
(adaptado do vestibular da UFSC – 2008) “A cor de muitas pedras preciosas se deve a presença de íons em sua composição química. Assim, o rubi é vermelho devido à presença de Cr3+, e a cor da safira é atribuída aos íons de Co2+, Fe2+ ou Ti4+.”
Em relação aos elementos cromo, cobalto, ferro e titânio é incorreto afirmar:
a) o raio atômico do íon Fe2+ é menor que o raio atômico do elemento Fe.
b) todos são elementos de transição externa.
c) o raio atômico do Cr3+ é maior que o raio atômico do elemento Cr.
d) o cromo pertence ao grupo 6 da tabela periódica.
e) todos os elementos citados pertecem ao quarto período da tabela periódica.
Questão 04
(adaptado PEIES – UFSM -2007) Sal de cozinha: mocinho ou bandido?
Os íons Na+, K+ e Cl– são essenciais para o balanceamento eletrolítico nos fluidos corporais, tendo importância no balanceamento ácido-básico e na transmissão de impulsos nervosos. Esses íons podem ser facilmente incorporados ao nosso organismo pela ingestão de sal de cozinha e também de alimentos processados. O excesso desses íons é prejudicial e pode ocasionar aumento da pressão arterial e desencadear doenças graves. Estudos alertam que, devido à presença de iodo no sal, o excesso afeta o sistema imunológico, podendo atacar as células da tireóide, o que ocasiona falência desse órgão. Por isso, numa entrevista à revista Cláudia, a Dra. Rosalinda Camargo, do Hospital das Clínicas de São Paulo, deu a dica: .Para prevenir, consuma no máximo 10 g de sal por dia, o equivalente a 2 colheres de chá, e esqueça os salgadinhos e enlatados..
Em relação ao sódio, potássio e cloro citados no texto, é correto afrimar:
a) o átomo de potássio possui menor eletropositividade que o átomo de sódio.
b) a energia de ionização do átomo de cloro é menor que a do átomo sódio.
c) a afinidade eletrônica do átomo de sódio é menor que a do átomo de cloro.
d) o átomo de sódio possui raio atômico menor que o do átomo de cloro.
e) é necessária muito menor energia para remover um elétron de um átomo de potássio que de um átomo de sódio.
Questão 05
(UDESC- 2010) A adsorção de íons é um dos fenômenos mais importantes na química do solo, pois é o principal atributo que afeta a concentração da maioria dos minerais na solução do solo. Dentre as propriedades físico-químicas, como eletronegatividade e polaridade, o tamanho do átomo apresenta influência direta na adsorção dos elementos.
K, Ca, Mn, Fe e Zn
Assinale a alternativa correta em relação à sequência dos elementos descritos acima.
a) O Zn é o maior elemento descrito na sequência acima, pois apresenta o maior número atômico.
b) O K é o menor elemento descrito na sequência acima, pois se encontra na família 1 A.
c) O Ca é o menor elemento descrito na sequência acima, pois apresenta número de oxidação 2+.
d) Os elementos estão ordenados em ordem crescente de raio atômico.
e) Os elementos estão ordenados em ordem decrescente de raio atômico.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

