Você já observou a embalagem de alguns produtos de limpeza, que orienta que eles sejam diluídos antes de sua utilização? Isso é explicado através de um assunto de química que é a diluição.
Vamos relembrar?
A diluição de soluções ocorre quando acrescentamos solvente (geralmente a água) a alguma solução, com isso o volume da solução aumenta e sua concentração diminui, porém a massa do soluto permanece inalterada.
Isso é feito, por exemplo, quando diluímos um produto de limpeza antes de usá-lo.
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? As melhores dicas!
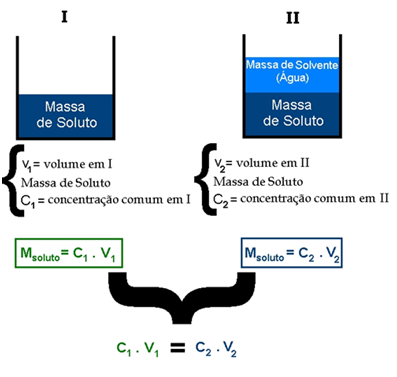
A concentração da solução inicial e final pode ser calculada a partir das expressões:
- Para a concentração inicial: C1 = m1 / V1
- Para a concentração final: C2 = m1 / V2
Como a massa m1 continua constante, podemos chegar à fórmula:
C1.V1 = C2.V2
Preste atenção!!
Não confunda diluição com dissolução. Quando estamos fazendo um suco e adicionamos o soluto (refresco em pó, por exemplo) ao solvente (água), está ocorrendo uma dissolução. Mas quando acrescentamos mais água a uma solução de água com refresco em pó, temos uma diluição.
Saiba um pouco mais sobre diluição de soluções assistindo a videoaula do Curso Enem Gratuito com o professor Sobis. Não deixe de conferir!
Dica 2– Complemente seus estudos acessando o nosso Blog do Enem e conferindo um super-resumo preparado especialmente para você sobre as reações de Neutralização. Não deixe de estudar!
Entendeu? Que tal um exemplo sobre diluição de soluções químicas para mandar bem nos próximos vestibulares e provas do Enem? Fique com a gente!
Imagine que se diluiu um suco desses em 3 L de água. Se a concentração inicial do suco era de 40g/L, significa que tinha uma massa de 40 g para cada litro do solvente. Mas como teremos 3 L, a massa será dividida por 3 e a concentração será então de aproximadamente 13, 33 g/L, ou 13 gramas para cada litro de solução. Porém, na solução inteira ainda permanece a massa do soluto de 40g.
O cálculo dessa nova concentração pode ser feito da seguinte maneira:
Solução inicial:
Ci: 40g/L
m1: 40g
vi: 1L
Solução final:
Cf: ?
m1: 40g
vf: 3L
Ci . vi = Cf . vf
(40 g/L) . (1 L) = Cf . 3L
Cf = 40 g /L
Dividindo por 3 temos:
Cf = 13,33 g/L
Dica 3 – Fique atento as dicas aqui no nosso Blog. Você já fez sua inscrição para o Enem? Inscrições Abertas Enem 2014: O que precisa? O que cai na prova? Saiba tudo! https://blogdoenem.com.br/inscricoes-enem-2014-saiba-tudo/
O Blog do Enem lança um desafio para você sobre diluição, vamos lá? Pode fazer a diferença na hora de resolver as provas do Enem e dos vestibulares!
A 200 mL de solução aquosa de ácido sulfúrico (H2SO4) 1,0 mol/L, será adicionada água até que o volume final da solução seja 500 mL. Qual deverá ser a concentração, em quantidade de matéria (mol/L), de ácido sulfúrico na solução final?
Resposta: 0,4 mol/L
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.


