Você lembra como se faz o cálculo do pH e do pOH de uma solução de ácidos fortes e bases? Faça revisão aqui com aula da Khan Academy e mande bem nas provas do Enem e do vestibular. Confira abaixo.
Olá! O nosso assunto hoje é sobre Ácidos e Bases. Você sabe fazer o cálculo do pH e do pOH? Se demorou meio segundo para responder que sim é porque está na hora de revisar!
Estamos aqui para ajudar você com um dos assuntos mais complicados de química das provas do Enem e dos vestibulares: Cálculo do pH e do pOH de soluções de ácidos fortes e bases.
Mas, fique tranquilo! Faça a sua revisão aqui nesta aula completa que tem vídeos, aula da Khan Academy, exercícios resolvidos e as explicações da professora Munique Dias.
Dica do Blog do Enem – Se você está em dúvida se recorda mesmo direitinho o que é Ácido, o que é Base, e sobre as diferentes Propriedades de Ácidos e Bases, talvez seja melhor dar uma paradinha aqui de cinco minutos e revisar os fundamentos sobre as Funções Inorgânicas: Ácidos e Bases, aqui.
Depois você volta e prossegue no cálculo do pH e do pOH. Você já deve ter escutado alguém dizer que o pH da água de uma piscina precisa ser controlado. Ou que o pH da água de um aquário ou de um solo, para favorecer um determinado plantio também precisa ser controlado ou corrigido.
Você já deve ter escutado alguém dizer que o pH da água de uma piscina precisa ser controlado. Ou que o pH da água de um aquário ou de um solo, para favorecer um determinado plantio também precisa ser controlado ou corrigido.
Até mesmo nosso sangue deve manter um pH sempre entre os valores de 7,35 e 7,45. Uma variação de 0,4 pode ser fatal!
Você sabe exatamente o que é o pH e o que significam seus valores? Ainda não? Então, é hora de aprender, porque o cálculo do pH sempre cai no Enem e nos vestibulares.
PH – O Potencial Hidrogeniônico (pH) consiste num índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer.
As substâncias em geral, podem ser caracterizadas pelo seu valor de pH , sendo que este é determinado pela concentração de íons de Hidrogênio (H+). Quanto menor o pH de uma substância, maior a concentração de íons H+ e menor a concentração de íons OH–.
Aula gratuita sobre Cálculo de pH
Confira a escala de pH nesta vídeo-aula gratuita do Professor Dimas, do canal Curso Enem Gratuito, e veja como calcular o pH de uma solução. Depois da aula tem mais conteúdo e mais dicas para você.
Então, gostou da aula do professor Dimas? Agora, no desenho abaixo você pode conferir diferentes valores de pH para vários produtos do nosso cotidiano.
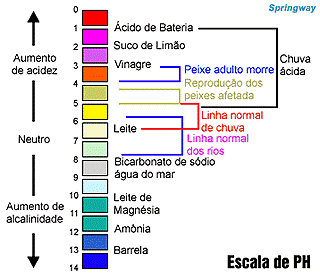
Como saber se uma solução é ácida ou básica? – Também é possível descobrir se uma solução é ácida ou básica, através dos indicadores de pH que são substâncias que mudam de cor na presença de íons H+ e OH– livres em uma solução.
Veja o exemplo:
Qual o pH de (a) sangue humano, no qual a molaridade de íons H3O+ é igual a 4,0 x10-8 mol.L-1; (b) KOH (aq) 0,040 M.
Resolução: o pH é calculado a partir da equação: pH=-log[H3O+]. Para os ácidos fortes, a molaridade do H3O+ é igual a molaridade do ácido; para ácidos espera-se pH<7. Para bases fortes, primeiro encontre a molaridade de OH–, então converta para [H3O+] usando [H3O+] [OH–]=Kw. Então:
a) Para uma solução na qual a molaridade dos íons H3O+ é a 4,0 x10-8 mol.L-1 ,
pH=-log (4,0 x10-8 ) = 7,40
b) Cada fórmula unitária de KOH (uma base forte) fornece um íon OH–, então a molaridade de OH– é 0,040 mol.L-1 :
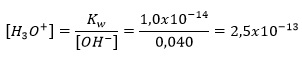
Consequentemente:
pH = -log (2,5×10-13 ) = 12,50
Agora um desafio pra você!
Calcule o pH de (a) amônia para limpeza caseira, para qual a molaridade de OH– é cerca de 3×10-3 mol.L-1; (b) HClO4(aq)6,0×10-5 mol.L-1
[Resposta (a) 11,5; (b) 4,22]
Dica 3 – Veja mais vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann no http://www.fundacaolemann.org.br/khanportugues/#videos
Dica 4 – Complete as suas revisões para o Enem e os vestibulares com as Apostilas Gratuitas que o Blog do Enem selecionou para você. Aulas, exercícios e dicas de todas as matérias. Tudo aqui: https://blogdoenem.com.br/category/apostila-enem/