Veja como calcular a quantidade de produto em uma reação química: resumo de Estequiometria com aulas Khan Academy, do professor Sobis, e da professora Munique Dias. Confira!
Olá, Que tal rever o Cálculo Estequiométrico? É um assunto muito cobrado nas provas do Enem e dos vestibulares? Estequiometria sempre cai, e geralmente é o terror para muitos alunos. E para você, também? ´
É disso mesmo que estamos falando, da estequiometria, mas não se assuste! Com as vídeo-aulas da Khan Academy e as explicações da professora Munique Dias você vai tirar de letra esse assunto e mandar super bem no Enem e nos vestibulares.
Então, aproveite o resumo inicial com o professor Felipe Sobis, do canal do Curso Enem Gratuito.
Resumo de Estequiometria
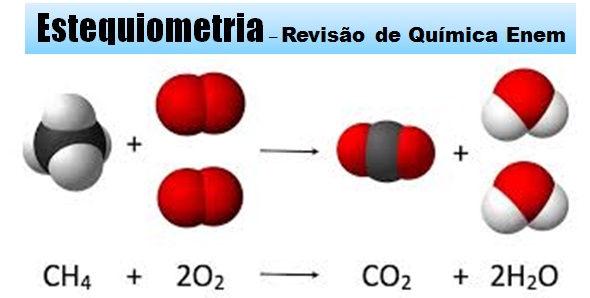
Estequiometria é o cálculo que permite relacionar as quantidades de reagentes e produtos, que participam de uma reação química, com o auxilio da reação química correspondente.
Exemplo de Cálculo Estequiométrico:
Para que você consiga realizar o cálculo estequiométrico de uma reação química, é necessário seguir algumas regras gerais: Siga este exemplo:
Suponha que você queira saber a massa de ferro que pode ser obtida de 10 Kg de óxido de ferro (III), FeO3, presente no minério de ferro por redução com CO em um alto forno:
-Primeiramente você deve escrever a reação:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Em segundo lugar é necessário acertar os coeficientes estequiométricos da equação, para que você possa ter a proporção exata das quantidades em mols dos participantes da reação.
1Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Então, sabemos que a proporção de Fe2O3 para Feque é de 1:2 ou seja, cada mol de óxido de ferro III formam 2 moles de ferro.
Também sabemos que:
Fe2O3 = 159,9 g/mol
Fe = 55,85 g/mol
Então como:
1 mol Fe2O3 – 2 mol Fe
159,9 g de Fe2O3 → 2×55,85 g de Fe
Agora é só aplicar a regra de três:
159,9 g de Fe2O3 ——————- 111,0 g de Fe
10000 g de Fe2O3 ——————– X
X = 6981,13 g de Fe ou 6,981 Kg de Fe
(Obs: 10 Kg = 10000 g)
Aulas gratuitas sobre Estequiometria
A primeira aula é um resumo bem completo sobre o Cálculo Estequiométrico. É com o professor Sobis, que atua no Curso Enem Gratuito. Confira:
Vamos revisar como é feita a Estequiometria de uma reação química? Assista agora ao vídeo da Khan Academy em que o professor Salman Khan explica sobre a Estequiometria das reações. Não deixe de conferir!
Dica 2: Quer relembrar como é feito o balanceamento químico das reações? Veja uma super revisão no blog do Enem e aproveite! https://blogdoenem.com.br/quimica-enem-khan-academy/
Vamos mandar super bem em estequiometria?
Assista mais uma vídeo-aula totalmente gratuita criada pelos professores Bruno e Luciana Werneck, do canal educacional o Kuadro, e mande bem nas questões de Química do Enem e dos vestibulares. Não deixe passar essa chance!!
Exercícios: – Vamos praticar? Agora que você já assistiu a nossa super revisão com vídeo-aulas e explicações, vai ficar fácil resolver qualquer problema sobre estequiometria das reações químicas, aqui vai um desafio:
Que massa de alumínio é necessária para reduzir 10 Kg de oxido de cromo III para produzir cromo metálico? A equação química de reação é:
Al(l) + Cr2O3(s) → Al2O3(s) + Cr (l)
Resposta: [3,55 Kg de alumínio]
Dica 4 – Veja os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann no http://www.fundacaolemann.org.br/khanportugues/#videos