Veja como identificar se uma gasolina está "batizada" com mais etanol do que deveria conter, ou se está diluída com solventes, querosene, óleo diesel e outros derivados de petróleo. É conteúdo de Química Orgânica para o Enem e os vestibulares.
Veja como descobrir se uma gasolina está adulterada, e aprenda sobre qual é a Química envolvida. É conteúdo básico sobre Química Orgânica. Veja para o Enem e os vestibulares.
No momento da escolha do posto de combustível em que vamos abastecer, pode vir à nossa cabeça: será que neste posto estão vendendo gasolina adulterada?  Isso pode ocorrer tanto em postos com preços promocionais, quando vemos aquelas filas quilométricas de carros em postos de combustíveis com preços excessivamente baixos, ou também em postos com “pinta de luxo”.
Isso pode ocorrer tanto em postos com preços promocionais, quando vemos aquelas filas quilométricas de carros em postos de combustíveis com preços excessivamente baixos, ou também em postos com “pinta de luxo”.
“Fraude” ou “adulteração” em combustíveis é a adição de qualquer produto que modifique suas características originais, inviabilizando a garantia do produtor”.
Infelizmente, essa é uma medida fraudulenta realizada por alguns postos e distribuidoras no Brasil que adicionam solventes ou outros compostos à gasolina a fim de tornar o produto mais lucrativo, prejudicando o consumidor.
No entanto, a qualidade do combustível diminui drasticamente e pode trazer prejuízos para o carro e para o bolso. Veja quais os produtos utilizados para adulterar a gasolina:
Geralmente, essa adulteração mais comum acontece quando é feita diluição de etanol à gasolina acima dos limites estabelecidos pela legislação. A atual é de 25% de etanol. Traduzindo: Um litro de “gasolina comum” no Brasil significa 750 mililitros de Gasolina derivada do refino do Petróleo, e mais 250 mililitros de Etanol, de álcool produzido a partir da cana de açúcar no país.
A margem de erro aceita pela Agência Nacional do Petróleo na mistura do etanol à gasolina é de 1%. Se esse limite for ultrapassado, o resultado será que no motor de explosão interna haverá uma mistura “pobre” de ar/combustível, levando a uma dirigibilidade menor, falhas de funcionamento do motor, diminuição do poder calorífico da gasolina e perda de desempenho.
Além do etanol, podem ser adicionados à gasolina também outros compostos derivados de petróleo que são miscíveis à gasolina, e que custam mais barato para os postos de combustíveis ou para as distribuidoras que falsificam o produto. Elas podem colocar óleo diesel ou querosene.
Também são usados outros solventes para falsificar a gasolina, como a aguarrás (Thinner) e o solvente para borracha (SPB ou benzina industrial). Este último é citado informalmente como um dos mais empregados nesse tipo de fraude.
Você deve estar pensando, mas porque são utilizados esses solventes? Não fique com dúvida! O blog do Enem explica para você.
Podemos analisar nos solventes citados acima utilizados na adulteração da gasolina, que todos têm uma característica em comum: SÃO MISCIVEIS/SOLÚVEIS NA GASOLINA.
A Solubilidade dos Compostos Orgânicos
A solubilidade de um sólido em um líquido ou miscibilidade entre os líquidos depende principalmente das forças intermoleculares existentes, daí a afirmação de que: substâncias polares se dissolvem em líquidos polares; substâncias apolares se dissolvem em líquidos apolares.
Ou como você já deve ter ouvido falar: “SEMELHANTE DISSOLVE SEMELHANTE”. A principal força intermolecular que atua entre as moléculas apolares é a do tipo dipolo induzido – dipolo induzido. 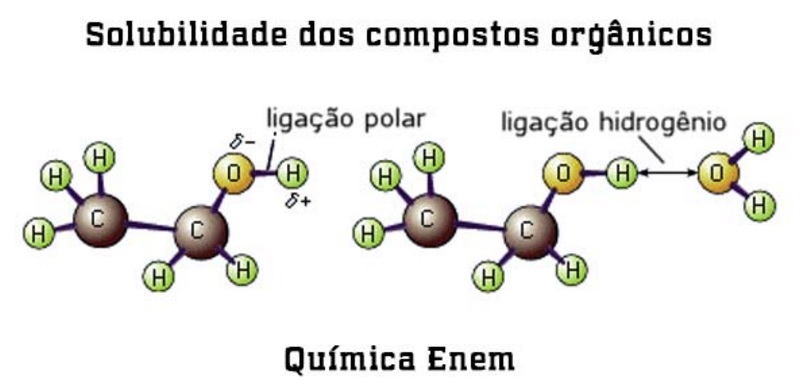
Compostos Orgânicos Solúveis:
Assim, como boa parte dos compostos orgânicos tem baixa polaridade, eles são solúveis em solventes apolares ou mesmo nos solventes pouco polares. Hidrocarbonetos, éteres, cetonas, e haletos orgânicos são exemplos de função orgânica cujos compostos constituem solventes muito utilizados para solubilizar substâncias orgânicas de baixa polaridade.
O iodo (I2) e tetracloreto de carbono (CCl4), são miscíveis por serem, ambos, apolares.  Veja na imagem um tubo de ensaio acima uma mistura de água (fase superior do tubo de ensaio) e tetracloreto de carbono.
Veja na imagem um tubo de ensaio acima uma mistura de água (fase superior do tubo de ensaio) e tetracloreto de carbono.
Substâncias Orgânicas (apolares) não se dissolvem na água: Como consequência, podemos verificar que a maioria das substâncias orgânicas (que são apolares) não se dissolve na água (que é um líquido polar). Um caso interessante a considerar é o dos álcoois. Os monoálcoois mais simples são totalmente miscíveis com água, como podemos observar na tabela abaixo.
Tabela de Solubilidade:

A solubilidade é devida, neste caso, as pontes de hidrogênio formadas entre as moléculas do álcool e da água.
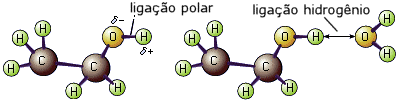
Pontes de hidrogênio entre a água e o etanol
Você observou que à medida que aumenta a cadeia carbônica, a miscibilidade em água diminui? Vamos ver porque isso acontece? – Para entender esse fato, vamos tomar como exemplo o etanol. Basta você lembrar que o álcool é formado por um grupo orgânico ( hidrofóbico) apolar, insolúvel em água e solúvel em solventes orgânicos, e pelo grupo OH (hidrofílico), altamente polar, solúvel em água.
Veja na imagem a Molécula de Etanol.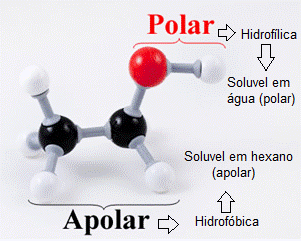
Assim, quanto maior o predomínio do grupo R, mais insolúvel em solventes polares o composto será, assim como, com o predomínio do grupo OH, maior será a solubilidade em solventes polares.
Seria impossível adulterar a gasolina com água, por exemplo, pois essa não se mistura a gasolina, ficando assim muito mais fácil para você reconhecer a adulteração!
Uma das consequências da adulteração da gasolina é quanto à eficiência do combustível, ou seja, você vai notar que quando abastecer seu carro com uma gasolina adulterada, ele andará menos quilômetros em relação à gasolina sem adulteração.
Mas porque isso acontece?
Isso se deve devido ao calor de combustão de cada combustível. O álcool quando é queimado libera uma menor quantidade de energia em relação à gasolina, por isso quanto mais álcool conter na sua gasolina, menor será a sua eficiência.
Saiba mais sobre calor de combustão acessando o link do Química total e assistindo a uma super videoaula ministrada pelo professor Paulo Valim. Não fique de bobeira! Cai nas provas de química dos vestibulares e no Enem.
https://www.youtube.com/watch?v=PX6ZwndTsiI
Dica 2 – Você acha difícil memorizar tudo que aprende? O Blog do Enem te da a dica, acesse o link e descubra quais as dicas para você memorizar o que estudou. Aproveite! https://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Como saber se a gasolina está adulterada?
Assista ao vídeo do laboratório didático virtual e saiba isso e muito mais sobre esse assunto. https://webeduc.mec.gov.br/portaldoprofessor/quimica/cd1/conteudo/aulas/10_aula/tempUpLoad/sim_qui_gasolinaadulterada.htm.
Para saber se você está sendo enganado ou não, existe um teste bastante simples que pode ser realizado, chamado de “teste da proveta”.
Vamos ver como é realizado o teste de proveta? Assista ao video do Falcão Bauer e saiba reconhecer se uma amostra de gasolina esta adulterada ou não.
https://www.youtube.com/watch?v=tbd67mcBXRg
Exercício sobre Gasolina Adulterada
Veja um exemplo de como se calcular a quantidade de alcool presente na gasolina:
Um consumidor ao realizar o teste da proveta, adicionou em uma proveta de 100 mL, 50 mL da amostra da gasolina que ele desejava analisar e 50 mL de água, logo em seguida agitou a mistura. Depois que as camadas se separaram, o volume da fase aquosa passou de 50 mL para 60 mL e a da gasolina ficou 40 mL. Qual a quantidade de álcool presente nessa amostra de gasolina?
Resolução: Após a agitação da mistura, como o volume da gasolina baixou de 50 mL para 40 mL, podemos concluir que 10 mL de álcool foram extraídos da gasolina. Baseado nisso, faz-se a seguinte regra de três para saber quanto isso representa em porcentagem:
50 mL — 100% 10 mL — x 50 . x = 10 . 100% x = 1000%/50 x = 20% de álcool na amostra da gasolina
Essa gasolina está dentro dos limites!
É possível também fazer esse mesmo calculo utilizando aexpressão matemática:
% álcool = Volume do álcool na gasolina . 100% Volume inicial da gasolina
Dica 3 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
“A maior recompensa pelo nosso trabalho não é o que nos pagam por ele, mas aquilo em que ele nos transforma”.
John Ruskin
Os textos e exemplos de apresentação desta revisão sobre Gasolina adulterada foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e atualmente cursa o doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique .