Geometria de uma molécula é a disposição dos átomos no espaço, considerando a posição dos núcleos. Estude com o Blog do Enem para se dar bem nas provas dos vestibulares e do Exame Nacional do Ensino Médio!
Você lembra da geometria de cada molécula? Que tal relembrar? Aproveite! veja a Teoria da Repulsão dos Pares Eletrônicos nesta aula gratuita.
A teoria da repulsão dos pares eletrônicos de valência (TRPEV), divulgada pelo cientista J.Gillespie, aponta que os pares eletrônicos (elétrons de valência, ligantes ou não) do átomo central se comportam como nuvens eletrônicas que se repelem e, portanto, tendem a manter a maior distância possível entre si. Mas, como as forças de repulsão eletrônica não são suficientes para que a ligação entre os átomos seja desfeita, essa distância é verificada no ângulo formado entre eles.
Mas, como as forças de repulsão eletrônica não são suficientes para que a ligação entre os átomos seja desfeita, essa distância é verificada no ângulo formado entre eles.
Geometria de uma molécula é a disposição dos átomos no espaço, considerando a posição dos núcleos. A geometria das moléculas é determinada pela posição dos átomos nas ligações, acompanhe os exemplos abaixo e confira os ângulos das diferentes estruturas atômicas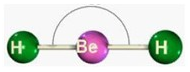 Essa imagem acima é de uma molécula presente em nosso DNA chamada de histona, ela possui uma estrutura plana, portanto dizemos que sua geometria é molecular linear. Repare que o ângulo das ligações é de 180°.
Essa imagem acima é de uma molécula presente em nosso DNA chamada de histona, ela possui uma estrutura plana, portanto dizemos que sua geometria é molecular linear. Repare que o ângulo das ligações é de 180°.
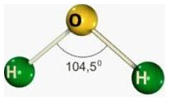 A molécula acima é de água (H20) é um exemplo de estrutura angular, os átomos de hidrogênio se posicionam formando ângulos de 104,5°. Dizemos então que essa é uma molécula de Geometria molecular angular.
A molécula acima é de água (H20) é um exemplo de estrutura angular, os átomos de hidrogênio se posicionam formando ângulos de 104,5°. Dizemos então que essa é uma molécula de Geometria molecular angular.
Agora, a molécula abaixo tem outra configuração. É um BH3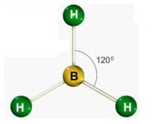 É um exemplo da Geometria molecular trigonal. Essa forma é caracterizada pelo ângulo de 120° entre as ligações.
É um exemplo da Geometria molecular trigonal. Essa forma é caracterizada pelo ângulo de 120° entre as ligações.
Dica do Blog > Observar nas imagens os ângulos formados na Geometria Molecular ajuda você a compreender melhor esta aula. Assim você fixa melhor os conteúdos para as provas do Enem e dos Vestibulares. Antes de assistir ao vídeo retorne às imagens para revisar pra valer.
Veja na imagem abaixo o metano (CH4).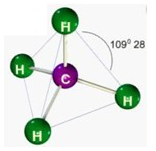 Observe que a estrutura retrata a Geometria molecular tetraédrica, a presença dos 4 átomos de hidrogênio e a formação do ângulo de 109,5° confirmam.
Observe que a estrutura retrata a Geometria molecular tetraédrica, a presença dos 4 átomos de hidrogênio e a formação do ângulo de 109,5° confirmam.
A amônia representa a uma molécula com geometria molecular piramidal, onde os átomos formam um ângulo de 107o.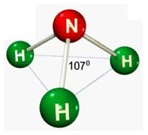 Confira na imagem acima a geometria molecular Piramidal.
Confira na imagem acima a geometria molecular Piramidal.
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
Dica 3 – Reveja também outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Densidade. Acesse o nosso blog do Enem e veja um super resumo preparado pela professora Munique Dias. Vai ficar de fora dessa?https://blogdoenem.com.br/revisao-quimica-revisar-densidade/
Você sabe encontrar a geometria de cada molécula?
Não se preocupe! O blog do Enem preparou algumas regras para você tirar de letra isso. Veja só:
|
Molécula (número de átomos) |
Geometria molecular |
Ângulo de ligação |
|
2 |
Linear (é plana) |
1800 |
|
3 |
Linear 1 (é plana) |
1800 |
|
|
Angular 2 (é plana) |
1050 (H2O) |
|
4 |
Trigonal plana 1(é plana) |
1200 |
|
|
Piramidal 2 (é espacial)) |
1070 |
|
5 |
Tetraédrica (é espacial) |
109028’ |
(1) Molécula SEM par de elétrons disponível. – > Na camada de valência do átomo central
(2) Molécula COM par de elétrons disponível. -> Na camada de valência do átomo central
Quer ver mais sobre geometria molecular e mandar muito bem nas questões de química dos vestibulares e do Enem? Então assista às videoaulas do prof. Sobis do Curso Enem Gratuito!
Curso Enem Gratuito
Quer aumentar suas chances no próximo Exame Nacional do Ensino Médio e mandar bem nas Notas de Corte do Enem? Estude com as apostilas e aulas gratuitas do Curso Enem Gratuito. Todas as matérias do Exame e ainda as Dicas de Redação. Acesse aqui.

