A isomeria plana verifica a diferença entre dois compostos através do estudo de suas fórmulas estruturais plana. Confira tudo agora para gabaritar no Enem e nos vestibulares:
Isomeria é o fenômeno caracterizado pela ocorrência de duas ou mais substâncias diferentes e que compõem a mesma fórmula molecular, porém nas fórmulas estruturais elas se diferem.
Veja agora dois exemplos de substâncias químicas que possuem a mesma fórmula molecular, mas diferem no nome e algumas propriedades:
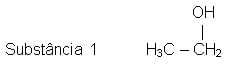
Fórmula molecular: C2H6O
Nome: etanol
Função: álcool
Ponto de fusão: -115°C
Ponto de ebulição: 78°C
Reatividade: alta
Estado físico a 25°C: líquido
![]()
Fórmula molecular: C2H6O
Nome: metóxi-metano
Função: éter
Ponto de fusão: -140°C
Ponto de fusão: -24°C
Reatividade: baixa
Estado físico a 25°C: gás
Isomeria Plana & Isomeria Espacial
Você lembra como pode ser classificada a isomeria? Fique ligado, cai nas provas dos vestibulares e do Enem! Confira no resumo com a professora Larissa Campos, do canal do Curso Enem Gratuito.
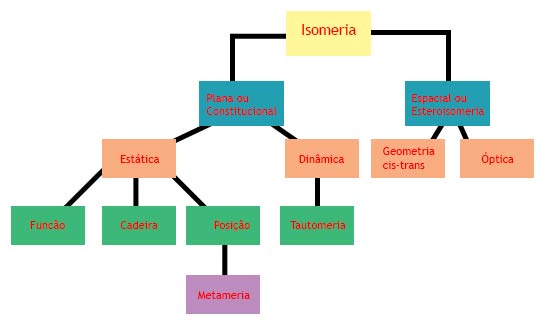
A isomeria pode ser classificada basicamente em dois tipos:
- Isomeria plana ou constitucional;
- Isomeria espacial ou esteroisomeria.
Que tal lembrar de um jeito mais fácil? O blog do Enem preparou para você um esquema dos tipos de isomerias para você nunca mais esquecer!
Isomeria Plana
Na isomeria plana verifica-se a diferença entre dois isômeros (compostos que sofrem isomeria) através do estudo de suas fórmulas estruturais planas. Temos cinco casos em que essa isomeria ocorre:
Vamos revisar mais sobre isomeria plana e mandar muito bem nas provas dos vestibulares e do Enem? Então acesse o link e assista a videoaula do Curso Enem Gratuito. Vamos lá, a hora é agora!
Isomeria Funcional
Isomeria de função ou funcional: A diferença entre os isômeros está no grupo funcional.
Exemplo: Fórmula molecular C3H6O
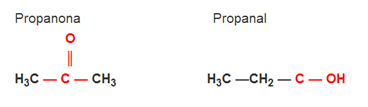
Veja que a propanona é do grupo das cetonas e o propanal é do grupo dos aldeídos.
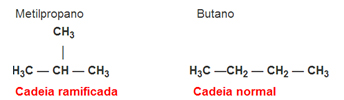
Isomeria de cadeia ou esqueletal: A diferença entre os isômeros está no tipo de cadeia. Por exemplo, um isômero é de cadeia aberta e o outro de cadeia fechada. Exemplo: Fórmula molecular C4H10
Isomeria de Posição
Isomeria de posição ou posicional: A diferença está na posição de uma insaturação, de um grupo funcional, de um heteroátomo ou de um substituinte.
Exemplo: Fórmula molecular C4H6

Metameria
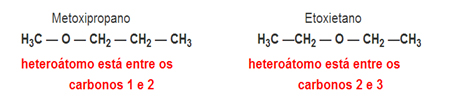
Isomeria de Compensação ou Metameria: É um tipo especial de isomeria de posição, em que a diferença consiste na posição do heteroátomo.
Exemplo:Fórmula molecular C4H10O
Tautomeria
Isomeria Dinâmica ou Tautomeria: É um tipo especial de isomeria de função, em que os isômeros coexistem em equilíbrio dinâmico em solução. Os dois principais tipos de tautomeria são entre uma cetona e um enol (equilíbrio cetoenólico) e entre um aldeído e um enol (equilíbrio aldoenólico).
Exemplo: Fórmula molecular C3H6O

Agora uma dica para você reconhecer de isomeria plana de uma substãncia. Siga o esquema que o blog do Enem preparou para você e não fique mais com dúvidas nas questões de Química sobre isomeria plana! Não eixe de conferir!
Veja Isomeria Espacial e Geométrica


