Ligação Polar x Ligação Apolar. Você lembra deste conteúdo sobre a Polaridade das Ligações Químicas? Se demorou para responder é hora de revisar aqui para o Enem e o Vestibular. Confira abaixo.
Que tal revisar um pouco sobre a polaridade das ligações? Cai nos maiores vestibulares do país e nas provas do Enem. Estude com a gente! Veja ligações ‘Polares’ e ligações ‘Apolares’.
Chamamos de polaridade a capacidade que as ligações possuem de atrair cargas elétricas, e o local onde ocorre este acúmulo denominamos de pólos, estes se classificam em pólos negativos ou positivos. Começando pelo começo: Para que você entenda melhor a polaridade das ligações, precisamos rever um conceito importante que é a eletronegatividade, então, vem com a gente!
|
Eletronegatividade: É tendência que o átomo de um determinado elemento apresenta para atrair elétrons, num contexto em que se acha ligado a outro átomo. |
Veja como cresce a eletronegatividade dos elementos químicos dentro da Tabela Periódica:

Reveja outras propriedades da tabela periódica acessando o nosso blog do Enem e conferindo um resumo completo sobre esse assunto. Revisão Gratuita sobre Tabela Periódica. Não deixe de conferir!
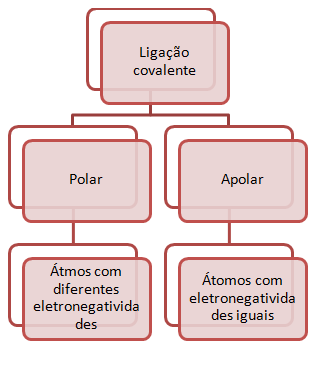
Ligações Polares e Ligações Apolares. É hora de revisar:
Veja o exemplo da molécula de ácido fluorídrico, HF.
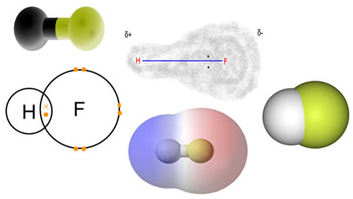
O par de elétrons compartilhado não é atraído igualmente por ambos os átomos, uma vez que o flúor é mais eletronegativo que o hidrogênio. Embora o par de elétrons esteja sendo compartilhado, ele encontra-se mais deslocado no sentido do flúor. A ligação entre esses dois átomos chama-se ligação covalente polar.
Lembre-se, para não mais esquecer e acertar no Enem e no Vestibular: Nesse tipo de ligação Covalente Polar dizemos que no flúor aparece uma carga parcial negativa e no hidrogênio uma carga parcial positiva.
Dica do Blog: Em nosso cotidiano podemos perceber diferenças entre substâncias iônicas, metálicas e moleculares. Por exemplo, em geral, as iônicas e metálicas são sólidas a temperatura ambiente; enquanto que as moleculares podem ser encontradas nos três estados físicos. Essas e outras diferenças entre as substâncias estão relacionadas com as polaridades das ligações que os átomos estabelecem entre si.
Relembrou? Não se preocupe! O blog do Enem preparou em esquema simples para você não esquecer mais e mandar ver nos vestibulares e no Enem. Aproveite!
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
Aula Gratuita sobre Polaridade nas Ligações:
Saiba mais sobre polaridade das ligações assistindo a uma videoaula do Curso Enem Gratuito!
Dica 3 – Reveja também outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Biodiesel. Acesse o nosso blog do Enem e veja um super resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-biodiesel-combustivel
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
Exercícios – Agora um desafio para você!
(FCMSC-SP) Na escala de eletronegatividade, tem-se:
Li H Br N O
1,0 2,1 2,8 3,0 3,5
Esses dados permitem afirmar que, entre as moléculas a seguir, a mais polar é:
a) O2 (g)
b) LiBr (g)
c) NO (g)
d) HBr (g)
e) Li2 (g)
Resposta: B
Os textos e exemplos de apresentação desta revisão sobre foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e atualmente cursa o doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique



