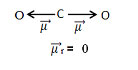Que tal relembrar um pouco sobre a polaridade das moléculas? Cai muito nas provas de química dos vestibulares e no Enem. Vem com a gente!
A polaridade de uma ligação e de uma molécula está relacionada à distribuição dos elétrons ao redor dos átomos.
Se essa distribuição for simétrica, a molécula será apolar, mas se for assimétrica, sendo que uma das partes da molécula possui maior densidade eletrônica, então se trata de uma molécula polar.
Você lembra o que é uma molécula? O blog do Enem te ajuda a relembrar… Molécula é um conjunto de átomos unidos entre si por ligações covalentes.  Ao analisarmos as estruturas das moléculas, podemos determinar se elas são polares ou não, levando em consideração dois fatores importantes: a diferença de eletronegatividade entre os átomos e a geometria da molécula.
Ao analisarmos as estruturas das moléculas, podemos determinar se elas são polares ou não, levando em consideração dois fatores importantes: a diferença de eletronegatividade entre os átomos e a geometria da molécula.
- Uma molécula cujas ligações são todas apolares será apolar. Assim, as moléculas das substâncias simples são apolares. Veja alguns exemplos: H2, F2, Cl2, O2, N2, P4, S8. Se a molécula for diatômica e formada por elementos de eletronegatividades diferentes, então, a molécula será polar. Exemplos: HCℓ, HF, HBr e HI.
Quer relembrar sobre os elementos mais eletronegativos e outras propriedades da tabela periódica? Então acesse o nosso site do Enem e confira um resumo fácil e simples de entender preparado pela professora Munique Dias. Não deixe de conferir!
A geometria da molécula interfere em como os elétrons estarão distribuídos nela e, consequentemente, na sua polaridade. Se a molécula for formada por três átomos ou mais, teremos que analisar cada ligação que é feita e a geometria da molécula. Veja um exemplo: CO2 – molécula linear:
δ– δ+ δ–
O = C = O
Observe que o oxigênio é mais eletronegativo que o carbono, por isso, os elétrons das ligações são mais atraídos para os oxigênios. Neles é formada uma carga parcial negativa (δ–), enquanto no carbono é formada uma carga parcial positiva (δ+). A multiplicação da distância entre os núcleos dos átomos ligados com essas cargas em módulo (isto é, somente o número sem sinal de positivo ou negativo) é chamada de momento dipolar e é representada por μ.
![]()
Esse momento dipolar é indicado por setas que apontam na direção do elemento mais eletronegativo, que atrai os elétrons: O ← C → O. Isso mostra que essa grandeza é um vetor (grandeza que apresenta módulo ou intensidade, direção e sentido). Portanto, ele é mais bem representado por: ![]()
Somando-se todos os vetores, encontramos o momento dipolar resultante, , que nesse caso deu igual a zero porque os dois momentos dipolares possuem valores iguais, mas vão em direções opostas, anulando-se.
Quando o vetor momento dipolar resultante der igual a zero, a molécula é apolar, mas quando der diferente de zero, ela será polar.
Portanto, no caso da molécula de CO2, ela é apolar.
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
Quer saber mais sobre a polaridade das moléculas? Então assista a 3 videoaulas totalmente gratuitas preparadas pelo Kuadro e mande bem nas questões de química dos vestibulares e no próximo Enem. Vai ficar ai de bobeira? Acesse já!
Aula 1:
Aula 2:
Aula 3:
Dica 3 – Reveja também outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Densidade. Acesse o nosso blog do Enem e veja um super resumo preparado pela professora Munique Dias. Vai ficar de fora dessa?
Você deve estar se perguntando, mas como saber se a molécula é apolar ou polar?O blog do Enem separou um roteiro para você seguir e nunca mais errar!
- Faça a geometria da molécula, ou seja, construa a fórmula estrutural plana ou espacial, tendo o conhe9cimento do ângulo de ligação.
- Coloque os vetores momentos dipolares nas ligações polares.
- Calcule a resultante vetorial.
Se:
– A resultante vetorial for nula ( µ = 0), a molécula será apolar.
– A resultante vetorial for diferente de zero ( µ ≠ 0),a molécula será polar.
A grande maioria das substâncias simples é apolar. O Ozônio (O3), embora seja uma substância simples, apresenta uma discreta polaridade, devido a sua geometria angular e à existência de um par eletrônico não compartilhado do átomo central.
Veja o detalhe:
– Moléculas simétricas: são apolares
– Moléculas assimétricas: são polares.
Tabela Periódica – Revise a Classificação dos Elementos Químicos
Agora um desafio para você!
Verifique se a molécula CCl4 é polar ou apolar.
Resposta: A molécula de CCl4 é rigorosamente simétrica e os vetores se anulam sendo a resultante vetorial igual a zero. Logo, a molécula é apolar.
Curso Enem Gratuito
Quer aumentar suas chances no próximo Exame Nacional do Ensino Médio e mandar bem nas Notas de Corte do Enem? Estude com as apostilas e aulas gratuitas do Curso Enem Gratuito. Todas as matérias do Exame e ainda as Dicas de Redação. Acesse aqui.