O 'Triângulo de Fogo': Combustível, Comburente, e Fonte de Ignição. Essas tríade é necessária para que se inicie a Reação Química de Combustão. Confira nesta aula de revisão sobre Combustão Completa, e sobre Combustão Incompleta. É Química no Enem.
A queima de materiais é uma reação química. Você sabe qual? – Se você respondeu ‘Combustão’, acertou de primeira. É isso mesmo, a queima de materiais é uma reação química de combustão. Cai nas provas dos vestibulares e também no Enem. Vamos relembrar?
Traduzindo para o ‘idioma’ da Química: Reação de combustão: Consiste na reação química entre dois ou mais reagentes (combustíveis e comburentes) com grande liberação de energia na forma de calor. É uma reação química exotérmica, ou seja, libera calor para o ambiente.
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
- Mas o que é necessário para que haja uma reação de combustão?

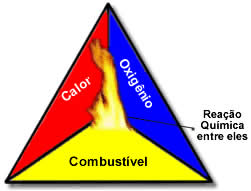
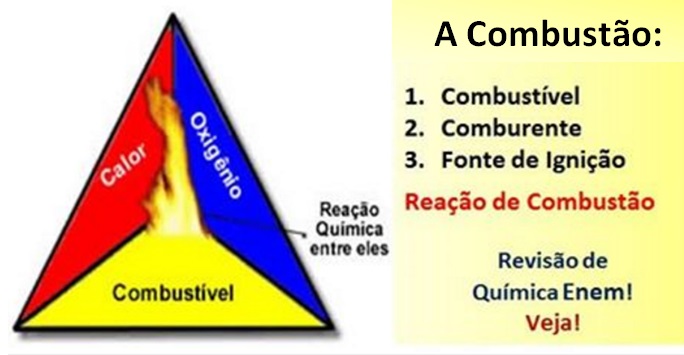
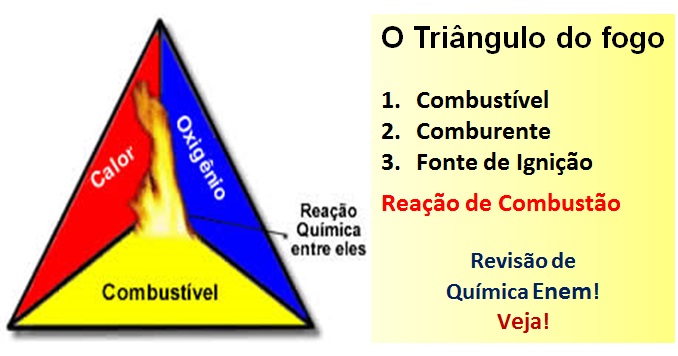
São necessárias três coisas, que formam o ‘Triângulo de fogo’. Veja a lista, e acompanhe a leitura com a imagem associada:
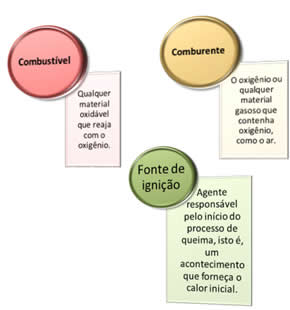
- Combustível – Qualquer material oxidável que reaja com o Oxigênio;
- Comburente – `Pode ser o Oxigênio, ou, também, qualquer outro material gososo que contenha Oxigênio. Como o ar, por exemplo, que contém Oxigênio;
- Fonte de Ignição – É o agenda que dispara o processo, que dá início ao processo de queima. É um evento que fornece o calor inicial necessário e suficiente para deflagrar o processo. Veja o diagrama do Triângulo de Fogo:
 Esses três fatores compõem o triângulo de fogo. Mas, depois que se dá início à reação de combustão, a energia liberada sustenta a reação e permite que ela continue até que o combustível, o comburente ou o calor (energia liberada), acabe. Isso significa que ocorrerá uma reação em cadeia.
Esses três fatores compõem o triângulo de fogo. Mas, depois que se dá início à reação de combustão, a energia liberada sustenta a reação e permite que ela continue até que o combustível, o comburente ou o calor (energia liberada), acabe. Isso significa que ocorrerá uma reação em cadeia.
A Reação de Combustão:
Na reação de combustão dos hidrocarbonetos ocorre a formação de gás carbônico (CO2) e água, a energia é liberada sob a forma de calor. Veja a equação de combustão:
H + O2 → CO2 + H2O
Quer saber mais sobre os hidrocarbonetos? Acesse o blog do Enem, e confira um super-resumo com vídeo aulas e explicações da professora Munique. Não deixe de conferir! https://blogdoenem.com.br/quimica-organicas-hidrocarbonetos/
Você lembra o que é combustão completa e combustão incompleta? Não se preocupe o blog do Enem explica tudo pra você. Se liga! Cai nas provas dos vestibulares e no próximo Enem.
Combustão completa:
A Combustão Completa ocorre quando é feita a ruptura completa da cadeia carbônica e a oxidação total de todos os átomos de carbono da cadeia carbônica.

Os produtos formados por hidrocarbonetos serão o CO2 (dióxido de carbono) e H2
Veja um exemplo de Combustão Completa:
Observe a combustão do Isoctano (um dos componentes da gasolina):
C8H18(g) + 25/2 O2 (g) → 8 CO2(g) + 9 H2O(l)
Você pode observar que há somente a formação de água e dióxido de carbono como produto final, caracterizando uma combustão completa.
Dica 2 – Você acha difícil memorizar tudo que aprende? O Blog do Enem te da a dica, acesse o link e descubra quais as dicas para você memorizar o que estudou. Aproveite! https://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
Combustão incompleta
A Combustão Incompleta ocorre quando não há quantidade de comburente necessária para a reação completa, ou seja, quantidade de oxigênio suficiente para queimar todo o combustível.

Os produtos formados são CO (monóxido de carbono) e H2O
Observe a mesma combustão do isoctano, no entanto, agora de modo incompleto:
C8H18(g) + 17/2 O2 (g) → 8 CO (g) + 9 H2O(l)
Os produtos formados já são o óxido de carbono e a água, caracterizando uma reação incompleta!
Aula Gratuita sobre Combustão
Quer saber mais sobre combustão? Assista a uma videoaula totalmente gratuita do canal Curso Enem Gratuito e mande bem nas provas dos vestibulares e do Enem. Aproveite essa chance!
Dica 4: Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
“Se quer viver uma vida feliz, amarre-se a uma meta, não a pessoas nem a coisas.”
Albert Einstein
Os textos e exemplos de apresentação desta revisão sobre reação de combustão foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e atualmente cursa o doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique .

 Esses três fatores compõem o
Esses três fatores compõem o 