Que tal relembrar um pouco sobre as Leis de Gay-Lussac? Veja aqui as Transformações isocóricas ou Isovolumétricas? Esse assunto é bastante cobrado nas provas do Enem e nos vestibulares de todo o Brasil. Vamos nessa!
Transformação isovolumétrica, isocórica ou isométrica é aquela em que o volume de gás permanece constante, porém ocorrem variações na pressão em reação às variações da temperatura. Veja nesta revisão de Química vestibular e Enem a Lei de Gay-Lussac.
Transformação Isovolumétrica
Para você entender a Transformação Isovolumétrica ou Isocórica, e compreender a Lei de Gay-Lussac é importante saber de onde vem o nome isocórica. – A palavra isocórica é de origem grega: ISSO (igual) + COROS (volume). Então, a Transformação Isocórica ou isovolumétrica ocorre a volume constante. Veja quem foi ‘o pai’ da Transformação Isovolumétrica ou Isocórica: Joseph Louis Gay-Lussac (1778-1850) foi um cientista francês que estudou as transformações dos gases, e que resultou no conhecimento das Transformações Isovolumétricas ou Isocóricas. Os estudos resultaram na Lei Volumétrica de Gay-Lussac.
Veja quem foi ‘o pai’ da Transformação Isovolumétrica ou Isocórica: Joseph Louis Gay-Lussac (1778-1850) foi um cientista francês que estudou as transformações dos gases, e que resultou no conhecimento das Transformações Isovolumétricas ou Isocóricas. Os estudos resultaram na Lei Volumétrica de Gay-Lussac.
A origem da CNTP
Você lembra das aulas de Química onde os professores martelavam a importância das CNTP (Condições Normais de Temperatura e Pressão)? Então, elas têm tudo a ver com a Lei da Gay-Lussac.
A Lei da Transformação Isovolumétrica de Gay-Lussac tem o seguinte enunciado: “Para uma massa fixa de gás, mantida a volume constante, a pressão exercida pelo gás é diretamente proporcional à temperatura absoluta”.
Isso quer dizer que se aumentarmos a temperatura dentro de um recipiente (volume constante) a pressão também irá aumentar, e isso é conseqüência do aumento das colisões entre as moléculas do gás. O volume se mantém, mas a pressão aumenta.
Esse enunciado pode ser expresso matematicamente como:
Traduzindo para você não esquecer a Lei da Transformação Isovolumétrica: Se você considerar um recipiente fechado e cheio de gás, ao aumentar a temperatura ocorre um aumento da pressão interna.
Este aumento da pressão é provocado pelo aumento das colisões entre as moléculas quando sobe a temperatura. É como se as moléculas ‘ficassem agitadas’.
Para você entender a representação matemática da Lei de Gay-Lussac: P = k.T , veja que ‘P’ é a Pressão; ‘T’ é a Temperatura, e ‘k’ é uma constante de proporcionalidade.
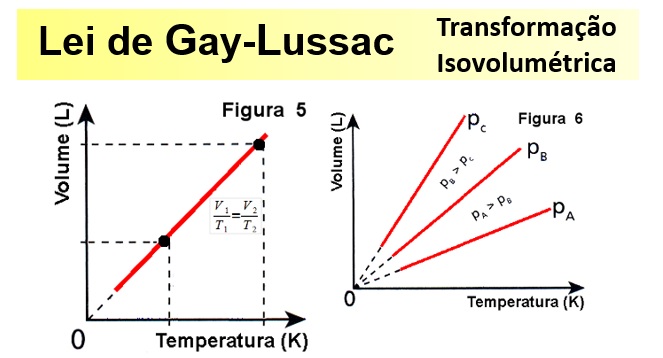
Ou, graficamente, o enunciado volumétrico da Lei de Gay-Lussac pode ser representado assim: 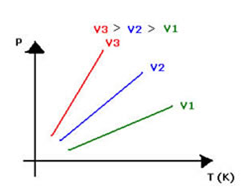 O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta .
O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta .
As Leis Ponderais
Veja agora um resumo complementar sobre as Leis Ponderais de Antoine Lavoisier e de Proust com o professor Felipe Sobis, do canal do Curso Enem Gratuito:
Estes cientistas foram mesmo uns caras geniais!
Dica 3 – Reveja também outro assunto que está relacionado com as transformações isobáricas que são as transformações isotérmicas Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/revisao-de-quimica/
A Transformação Isocórica
Onde você pode observar uma transformação isovolumétrica ou isocórica?
Essa transformação isovolumétrica pode ser vista, por exemplo, nos pneus de carros, motos e caminhões. Com um aumento de sua temperatura, a pressão dentro dos pneus aumenta.
Por isso é necessário calibrar constantemente os pneus, ou seja, regular os níveis da pressão provocada pelos gases que os enchem. Isso garante seu melhor desempenho e também a segurança dos passageiros.
Aulas Gratuitas das Transformações
Quer saber mais sobre as transformações isocórica? Então assista a videoaula do professor Reinaldo Souza e fique por dentro desse assunto.
Exercícios!
Agora um desafio para você! Tente resolver essa questão sobre transformação isocórica e depois confira a resolução do problema.
1) (FUVEST – SP) Um recipiente indeformável, hermeticamente fechado, contém 10 litros de um gás perfeito a 30 ºC, suportando a pressão de 2 atmosferas. A temperatura do gás é aumentada até atingir 60º C. Calcule a pressão final do gás.
Resolução:
Considerando-se que o volume do gás é constante, temos que a transformação é isocórica.
Assim,
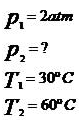
Substituindo os valores fornecidos pelo problema na equação da transformação isocórica, temos:
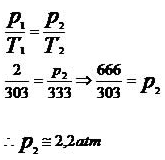
Assim, podemos concluir que a pressão e a temperatura são grandezas diretamente proporcionais.
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.

