Você lembra o que acontece quando misturamos ácidos com bases? Ocorrem reações de neutralização! Que tal relembrar e mandar ver na prova do Enem e dos vestibulares de todo Brasil? Estude com a gente!
Talvez você já tenha tido a desconfortável sensação de uma forte azia, certo? O ácido estomacal voltando pelo seu esôfago causa uma incômoda queimação na garganta. Para acabar com isso, você pode, por exemplo, tomar um medicamento chamado de leite de magnésia, que logo alivia a azia.
Por que a sensação passa? Por que ocorre uma reação de neutralização! Saiba mais sobre esse fenômeno nesta super aula da professora Munique Dias e gabarite as questões de Química Enem!
O que são as reações de neutralização?
Você provavelmente lembra que, segundo a definição de Arrhenius, os ácidos possuem pH abaixo de 7 (pH ácido) e que as bases possuem pH acima de 7 (pH básico). Já a água pura, que é neutra, possui o pH 7, ou seja, pH neutro. Lembrou? Beleza. Quando juntamos um ácido e uma base, acabamos formando água – que é neutra. Além disso, ao reagirem, os ácidos e bases formam outros compostos que não possuem os potenciais de ácidos e bases. Resumidamente falando, um reação de neutralização ocorre quando juntamos um ácido e uma base, obtendo como produto um sal e água. Veja o exemplo a seguir:
Na imagem você pode ver, pelas cores, como os reagentes interagem entre si firmando os produtos. Na reação, as letras A e B são utilizadas para representar as partes das substâncias e como elas se rearranjam.
Mas, por que isto ocorre? Por que os elementos se recombinam assim? Ainda segundo a teoria de Arrhenius, o ácido libera em meio aquoso um cátion, o hidrogênio (H+), enquanto a base libera como único ânion a hidroxila (OH–); portanto, quando colocados para reagir, o H+ do ácido reage com o OH– da base, uma vez que o cátion possui um elétron a menos e o ânion um elétron a mais. Assim, esses íons neutralizam-se, formando a água que como disse acima possui pH 7 (meio neutro, se a neutralização for total).
Dica 1– Você não lembra da maioria das características dos ácidos e das bases? Sem problemas! O Blog do Enem te ajuda a relembrar Química Enem. Veja este post da professora Munique Dias e relembre o assuntos!
Veja uma dessas reações entre o ácido clorídrico e o hidróxido de sódio: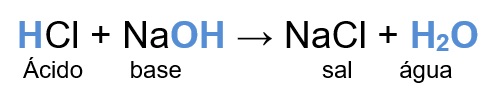 Esta reação pode ser considerada uma reação de neutralização total, porque o ácido forneceu apenas um cátion H+ que foi neutralizado pelo único ânion OH– liberado pela base. E o que acontece quando a quantidade de cátions H+ liberados pelo ácido e a quantidade de ânions OH– liberados pela base não forem iguais?
Esta reação pode ser considerada uma reação de neutralização total, porque o ácido forneceu apenas um cátion H+ que foi neutralizado pelo único ânion OH– liberado pela base. E o que acontece quando a quantidade de cátions H+ liberados pelo ácido e a quantidade de ânions OH– liberados pela base não forem iguais?
Existem duas possibilidades: pode ocorrer a neutralização parcial do ácido ou a neutralização parcial da base. Vamos ver ambos os tipos de reações.
Neutralização parcial do ácido:
Na neutralização parcial do ácido, ocorre o fornecimento de uma quantidade maior de cátions H+, em comparação aos ânions OH–.
Veja a reação do ácido fosfórico (H3PO4), com o hidróxido de sódio (NaOH): Nesta reação 0 H3PO4 fornece três cátions H+, enquanto que o NaOH fornece apenas um ânion OH–. Como cada cátion H+ neutraliza apenas um ânion OH–, nesse caso, teremos a formação de apenas uma molécula de água e o ácido será neutralizado parcialmente.
Nesta reação 0 H3PO4 fornece três cátions H+, enquanto que o NaOH fornece apenas um ânion OH–. Como cada cátion H+ neutraliza apenas um ânion OH–, nesse caso, teremos a formação de apenas uma molécula de água e o ácido será neutralizado parcialmente.
Nessa equação química, ocorre a formação de um sal ácido, também chamado de Hidrogenossal, formado entre o cátion da base (Na+) e âniom do ácido que não foi neutralizado (H2PO4–).
Dica 2– Reveja também outro assunto muito importante e muito cobrado nas provas do Enem e dos vestibulares de todo Brasil. Acesse o nosso blog do Enem e veja um super-resumo sobre Cálculo estequiométrico preparado pela professora Munique Dias. Vai ficar de fora dessa?
Neutralização parcial da base:
Nesse caso, a quantidade de hidrogênios ionizáveis do ácido não é suficiente para neutralizar as hidroxilas da base.
Vamos ver o exemplo da reação do ácido nítrico com o hidróxido de magnésio: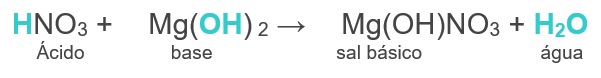 Veja que o ácido libera apenas um cátion H+, enquanto que a base libera duas hidroxilas (OH–). Assim, a base não será neutralizada totalmente, terá a formação de uma molécula de água e uma hidroxila irá restar. O cátion formado pela base [Mg(OH)+] reagirá com o ânion formado pelo ácido (NO3-1) e formará um sal básico ou hidroxissal.
Veja que o ácido libera apenas um cátion H+, enquanto que a base libera duas hidroxilas (OH–). Assim, a base não será neutralizada totalmente, terá a formação de uma molécula de água e uma hidroxila irá restar. O cátion formado pela base [Mg(OH)+] reagirá com o ânion formado pelo ácido (NO3-1) e formará um sal básico ou hidroxissal.
Saiba mais sobre as reações de neutralização assistindo a vídeo aula do Química Simples, não deixe de conferir!
Agora, para finalizar sua revisão. que tal testar seu conhecimento? Você consegue resolver este exercício?
(Unisinos-RS) Ao participar de uma festa, você pode comer e beber em demasia, apresentando sinais de má digestão ou azia. Para combater a acidez, ocasionada pelo excesso de ácido clorídrico no estômago, seria bom ingerir uma colher de leite de magnésia, que irá reagir com esse ácido.
A equação que representa a reação é:
- a) Mg(OH)2 + 2 HClO → Mg(ClO)2 + 2 H2
- b) Mg(OH)2 + 2 HCl → MgCl2 + 2 H2
- c) Mg(OH)2+ 2 HClO3 → Mg(ClO3)2 + 2 H2
- d) Mn(OH)2+ 2 HClO2 → Mn(ClO2)2 + 2 H2
- e) Mn(OH)2+ 2 HCl → MnCl2 + 2 H2
Resposta: B
Os textos e exemplos de apresentação desta revisão foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique

