Na aula de hoje revise seus conhecimentos sobre reações de oxirredução. Aqui você encontra exemplos e exercícios com gabarito. Acesse e tire suas dúvidas.
Você lembra das aulas de química sobre as reações onde sempre tem um elemento que perde elétrons e outro que ganha elétrons? Você sabe quem ganha e quem perde nas reações Óxi Redox? Bora revisar nesta aula gratuita.
Sim, é claro que estamos falando das reações de oxirredução. Elas também são conhecidas por Óxi-Redox.
Uma reação de oxirredução é caracterizada como um processo simultâneo de perda e ganho de elétrons, pois os elétrons perdidos por um átomo, íon ou molécula são imediatamente recebidos por outros.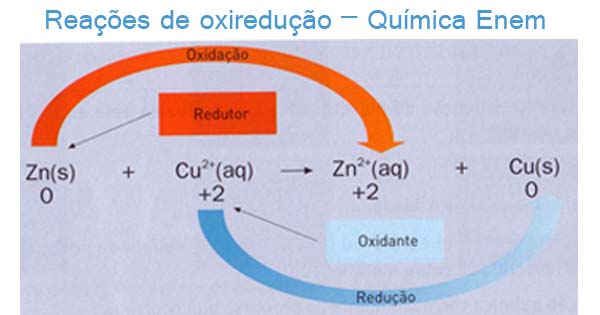 A oxidação ocorre quando o átomo perde elétrons, que como são partículas negativas, a carga elétrica (Número de oxidação – Nox) da espécie que perdeu elétrons aumenta, “ficando mais positiva”.
A oxidação ocorre quando o átomo perde elétrons, que como são partículas negativas, a carga elétrica (Número de oxidação – Nox) da espécie que perdeu elétrons aumenta, “ficando mais positiva”.
A redução corresponde ao processo inverso, ou seja, a espécie química ganha elétrons e fica com o Nox menor, “mais negativo”.
Entendeu? Pra reforçar um pouco mais, observe o resumo abaixo neste quadro: Fonte: http://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm
Fonte: http://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm
Veja também esta videoaula do prof. Sobis do Curso Enem Gratuito:
Dica 1– Você acha difícil memorizar tudo que aprende? O Blog do Enem pode te ajudar! Acesse o link e descubra quais as dicas para você memorizar o que estudou.
Assim, se um uma reação química o Nox do reagente for menor que o do produto, isto quer dizer que o Nox aumentou, significando que ele perdeu elétrons na reação. Por outro lado, se o Nox do produto for menor, significa que ele diminuiu, acusando que essa espécie química ganhou elétrons.
Nas reações redox, a espécie que cede um ou mais elétrons, é chamada de redutor, e está da origem a outra espécie que recebe esses elétrons, chamada de oxidante.
Essas espécies constituem um par conjugado redutor/oxidante ou par redox conjugado.
Vamos observar a figura abaixo: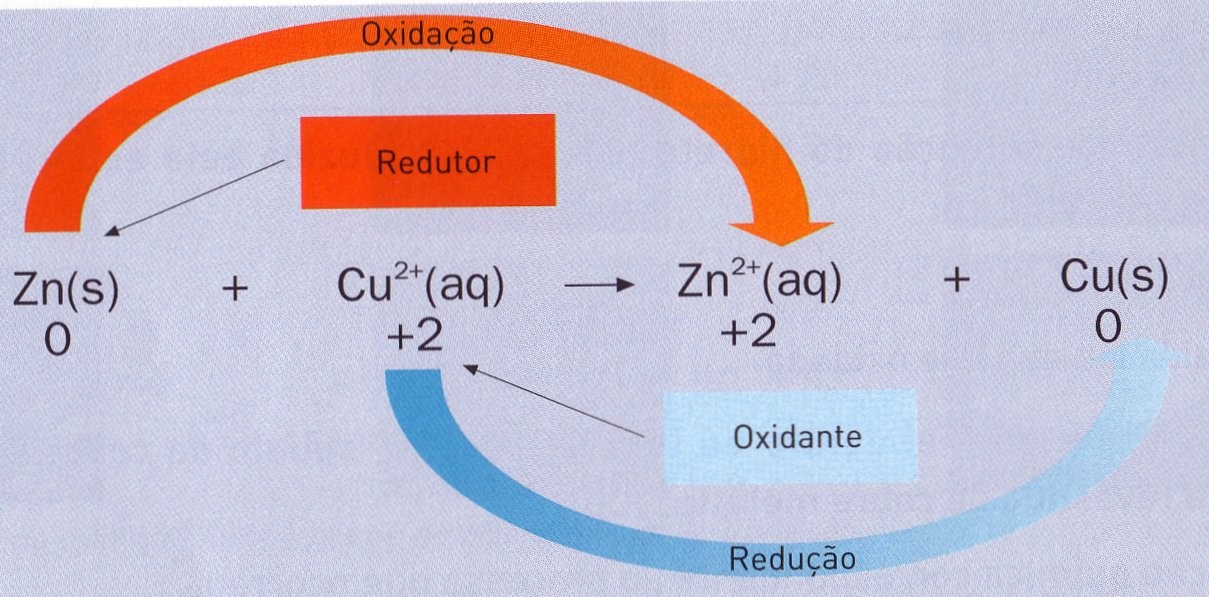 Na reação acima, o Zinco (Zn) é o agente redutor, pois perdeu dois elétrons, sofrendo uma oxidação. Já o cobre (Cu) é o agente oxidante, ganhando dois elétrons na reação, sofrendo assim uma redução.
Na reação acima, o Zinco (Zn) é o agente redutor, pois perdeu dois elétrons, sofrendo uma oxidação. Já o cobre (Cu) é o agente oxidante, ganhando dois elétrons na reação, sofrendo assim uma redução.
Assim, para a reação anterior os pares redox conjugados são: Zn / Zn2+ e Cu / Cu2+.
Oxidação do Álcool Etílico – O Álcool etílico presente no vinho oxida-se em contato com o oxigênio, isto é, acontece a formação de compostos com maior quantidade de átomos desse elemento.
Oxidação e Redução – Entenda como os dois processos se relacionam:
A oxidação do álcool implica em um processo de transferência de elétrons. Assim, se o álcool etílico sofre a Oxidação, outra espécie deve se reduzir. Efetivamente, ocorre a Redução do oxigênio do ar. Veja na equação da reação. 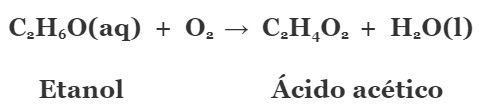 No lado esquerdo estão os reagentes, e no lado direito os produtos resultantes. Entretanto, por não envolver a formação de íons a percepção da transferência de elétrons entre as espécies não é facilmente verificada.
No lado esquerdo estão os reagentes, e no lado direito os produtos resultantes. Entretanto, por não envolver a formação de íons a percepção da transferência de elétrons entre as espécies não é facilmente verificada.
A questão é: Como reconhecer quais substâncias perdem ou ganham elétrons?
– A solução para saber quais substâncias perdem ou ganham elétrons está na determinação do numero de oxidação (Nox) dos átomos dos elementos envolvidos no processo.
Número de Oxidação (Nox) – É o número que indica o número de elétrons que um átomo ou íon perde ou ganha para adquirir estabilidade química. Quando o átomo ou o íon perde elétrons, seu Número de Oxidação, o Nox, aumenta, quando ganha elétrons, seu Nox diminui.
Veja na musiquinha da paródia, para não esquecer:
Os professores Sobis e Caio, que dão aulas de Química em Florianópolis (Santa Catarina), prepararam para você uma paródia sobre quem ganha e quem perde elétrons nas reações de Oxidação e Redução.
É bem rápida e super engraçada. Você aprende de uma vez por todas. Confira. O vídeo é do canal Curso Enem Gratuito:
Gostou do Vídeo? Demais!
Existem várias reações de oxiredução no nosso cotidiano, que não temos conhecimento, que tal estudar sobre uma delas?
Fotossíntese: realizada pelas plantas, algas e algumas espécies de bactérias, na fotossíntese, a água e o gás carbônico (dióxido de carbono – CO2) reagem na presença de luz para a produção de moléculas orgânicas (estruturas que contêm o carbono como elemento principal).
Um exemplo de molécula orgânica produzida é a glicose (C6H12O6): Veja que o carbono sofreu redução, pois seu Nox passou de +4 para zero, enquanto o oxigênio sofreu oxidação, pois seu Nox passou de -2 para zero.
Veja que o carbono sofreu redução, pois seu Nox passou de +4 para zero, enquanto o oxigênio sofreu oxidação, pois seu Nox passou de -2 para zero.
Aula Gratuita de Oxidação e Redução
Que tal reforçar ainda mais os estudos sobre as reação de oxiredução e mandar bem nas provas dos vestibulares e do Enem? Então não deixe de assistir a videoaula do professor Igor do Hexag Medicina e fique fera! Não deixe de conferir!
Dica 2 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares: os Aldeídos. Acesse o blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa?
Você consegue resolver este exercício sobre reações de oxiredução? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
(UFMG-MG) Considere as seguintes equações:
I. HCℓ + NaOH → NaCℓ + H2O
II. H2 + ½ O2 → H2O
III. SO3+ H2O → H2SO4
Ocorre oxirredução apenas em:
a) I.
b) II.
c) III.
d) I e III.
e) II e III.
Resposta: b
Os textos e exemplos de apresentação desta aula foram preparados pela professora Munique Dias para o Blog do Enem.  Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .
Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .
