Preparado para o Exame Nacional do Ensino Médio? Relembre sobre as classificações das reações químicas e balanceamento de equações com este resumo online gratuito. Entenda os fundamentos para resolver as questões de Química nas provas do Enem, do Encceja e dos Vestibulares. Vem!
Reações Inorgânicas – Revisão de Química Enem sobre Reações químicas e Transformações de substâncias
É incalculável a quantidade de reações químicas, pois elas se manifestam nas mais formas e locais. Acontecem a todo instante, sejam em nosso corpo, o grande laboratório da vida, seja no motor de combustão de um carro em movimento, seja mesmo na formação da chuva ácida que agride o ambiente.
Em geral, as transformações podem ser visualizadas quando ocorrem: formação de substâncias insolúveis, mudança de cor de um sistema, desprendimento de um gás. Em alguns casos, são necessários outros métodos para verificar a ocorrência de uma reação.
Equação Química
Cada reação química é representada por uma equação química. Colocam-se os reagentes no primeiro membro e os produtos no segundo membro separados por uma seta.
As substâncias são representadas por meio de suas fórmulas, e o número de átomos de cada elemento presente no primeiro membro deverá ser igual ao número de átomos desse elemento no segundo membro.
Para conseguir essa igualdade, faz-se o balanceamento da reação, isto é, utiliza-se o balanceamento da reação, isto é, utiliza-se certo número de moléculas de reagentes e produtos, cujos valores são denominados coeficientes da equação.
Ex: A água pode ser obtida pela reação entre hidrogênio e o oxigênio: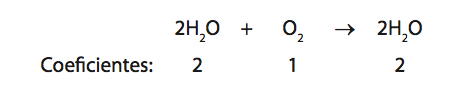
Quando se queima o etanol (álcool comum), produz-se gás carbônico e vapor de água: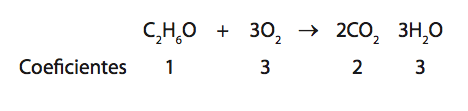
Veja a videoaula da prof. Larissa para entender ainda melhor o conteúdo:
Balanceamento de Equações
Balancear as equação química é acertar seus coeficientes. Uma das formas de balanceamento é o método das tentativas, que consiste em:
- Procurar um elemento que se apresente apenas num reagente (1o membro) e apenas num produto (2o membro).
- Determinar os coeficientes das substâncias a que esse elemento pertence, igualando seu número de átomos.
- Partindo-se do par de coeficientes dados inicialmente, igualar o número de átomos dos demais elementos e assim encontrar os coeficientes restantes.
Exemplos:
- O2 + F2 → OF2
- Acertando a quantidade de O: O2 + F2 → 2OF2
- Acertando a quantidade de F: O2 + 2F2 → 2 FO2 (equação balanceada)
- P+O2 →P2O3
- Acertando a quantidade de P: 2P + O2 → P2O3
- Acertando a quantidade de O: 2P + O2 → 2P2O3
- No 2º membro, o número de átomos de P foi alterado; portanto é preciso rever a quantidade P. 4P + 3O2 → 2P2O3 (equação balanceada)
Aula Gratuita: O Balanceamento Químico
Confira agora com o professor Sobis, do Curso Enem Gratuito, um resumo simples e rápido sobre como fazer o Balanceamento de Equações Químicas.
Classificação das reações químicas
Baseando-se em critérios como a natureza das substâncias (simples ou compostas) e a quantidade de reagentes e produtos, classificam-se as reações em: reações de síntese, de decomposição, de simples troca ou deslocamento ou e de dupla troca.
Dica 1 – Entenda como identificar o Grau de Pureza dos Reagentes e o Rendimento da Reação nesta aula de Química Enem – https://blogdoenem.com.br/calculo-estequiometrico-quimica-enem/
Reações de síntese: são aquelas em que um único produto é obtido a partir de vários reagentes. São também denominadas reações de composição ou de adição.
Se os reagentes forem substâncias simples, a reação será chamada de síntese total. Se forem substâncias compostas, a síntese será denominada parcial.
Exemplos
- Síntese total: N2 + 3H2 → 2NH3
- 2Mg + O2 → 2MgO (esta é a reação que ocorre no flash descartável)
- Síntese parcial: 2SO2 + O2 → 2SO3
- CaO + H2O → Ca(OH)2 (a cal virgem em presença de água resulta na cal extinta ou na cal apagada usada para caiar paredes)
Dica 2 – Ácidos, bases, sais e óxidos. Entenda como são constituídas as funções inorgânicas e saiba como não errar as suas nomenclaturas nesta aula de Química Enem – blogdoenem.com.br/funcoes-inorganicas-quimica-enem/
Aula Gratuita de Equilíbrio Químico
Confira nova aula-resumo do professor Sobis, para você completar sua revisão sobre Equilíbrio Químico:
As Reações de decomposição:
são aquelas em que vários produtos são obtidos a partir de um único reagente e são denominadas reações de análise.
- Exemplos:
- CaCO3 → CaO + CO2 (decomposição do carbonato de cálcio)
- 2NaCl → 2Na + Cl2 (decomposição do NaCl)
- 2AgBr → 2Ag + Br2 (decomposição do brometo de prata)
Reações de simples troca ou decomposição: ocorrem entre uma substância simples e uma composta produzindo novas substâncias: uma simples e uma composta.
- Exemplos:
- Cl2 + 2NaBr → 2NaCl + Br2 (o cloro está deslocando o bromo)
- 2Al + 6HCl → 2AlCl3 + 3H2 (o alumínio está deslocando o hidrogênio)
- Reações de dupla troca: ocorrem entre duas substâncias compostas produzindo duas novas substâncias compostas.
- Exemplos:
- NaOH + HCl → NaCl + HOH
- Al2(SO4)3 + 3Ca(OH)2 → 2Al(OH)3 + 3CaSO4
Desafios
Questão 01
Em relação às equações químicas a seguir, assinale a opção correta:
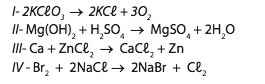
a) I representa uma reação de síntese, no caso, do clorato de potássio.
b) IV representa uma reação de simples troca espontânea.
c) II representa uma reação de hidrólise de um sal.
d) II representa uma reação de oxirredução.
e) III representa, simultaneamente, uma reação de deslocamento e de oxirredução espontânea.
Dica 3 – As Ligações Químicas acontecem entre os átomos dos elementos. Entendas as regras que determinam os tipos de ligações nesta aula de Química Enem – https://blogdoenem.com.br/revisao-sobre-ligacoes-quimicas-quimica-enem/
Questão 02
Considerando as reações químicas representadas pelas equações da coluna I, faça associação com os dados da coluna II, de acordo com a classificação correta:
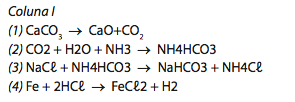
Coluna II
(I) reação de síntese ou adição
(II) reação de decomposição ou análise
(III) reação de deslocamento
(IV) reação de dupla troca
a) 1 – II; 2 – III; 3 – I; 4 – III
b) 1 – II; 2 – I; 3 – IV; 4 – III
c)1-I;2-II;3-III;4-IV
d) 1 – I; 2 – III; 3 – II; 4 – IV
e) 1 – III; 2 – IV; 3 – I; 4 – II
Questão 03
Considere as afirmativas:
I – O cálcio metálico, sólido, reage com água para produzir hidróxido de cálcio e hidrogênio gasoso.
II – O magnésio reage com bromo e produz brometo de magnésio.
III – Quando se aquece o hidrogenossulfito de sódio, forma-se o sulfito de sódio e há desprendimento de dióxido de enxofre, gasoso, e de vapor de água.
As reações descritas em I, II e III são classificadas, respectivamente, como
a) deslocamento, adição e decomposição.
b) deslocamento, adição e combustão.
c) dupla-troca, adição e decomposição.
d) dupla-troca, adição e combustão.
e) adição, deslocamento e decomposição.
Questão 04
Alumínio metálico reage com ácido sulfúrico produzindo sulfato de alumínio e gás hidrogênio, conforme a seguinte equação não-balanceada:
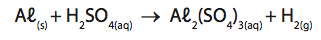
Com relação ao processo e com base em seus conhecimentos, assinale a afirmativa INCORRETA.
a) O alumínio sofre uma oxidação.
b) O hidrogênio sofre uma redução.
c) O estado de oxidação do enxofre no H2SO4 é + 6.
d) Após o balanceamento da equação, a soma dos coeficientes mínimos e inteiros das espécies envolvidas é igual a 8.
Questão 05
A reação da hematita (fórmula química Fe2O3) com monóxido de carbono (CO) em alto-forno representa o processo industrial para a obtenção do ferro metálico (Fe), que, após resfriamento, solidifica-se.
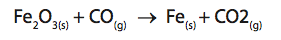
Assinale a alternativa CORRETA:
a) O monóxido de carbono atua como agente catalisador.
b) Os coeficientes da equação química balanceada são 1,2,2,2.
c) A hematita atua como agente redutor.
d) O íon ferro, na hematita, recebeu três elétrons.
e) Este método de obtenção do ferro é chamado de processo eletrolítico.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

