Você lembra a teoria do octeto? E as suas exceções? Que tal rever esse assunto e mandar ver na prova do Enem e dos vestibulares de todo Brasil? Não deixe de estudar!
Teoria do octeto: Na natureza, poucos elementos aparecem como átomos isolados, de forma estável. Esses elementos fazem parte do grupo dos gases nobres (família 18, ou 8A). Isto ocorre, pois apresentam sua última camada completa: o elemento He com 2 elétrons e os demais elementos com 8 elétrons.
Os demais, para permanecerem estáveis, realizam ligações químicas. Uma ligação química se estabelece quando dois átomos se combinam. Para saber mais sobre o assunto, veja este super post e arrase nas questões de química do Enem e dos vestibulares!
Dica 1– O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
TEORIA DO OCTETO
Embora existam muitas exceções à teoria (ou regra) do octeto, ela ainda é bastante utilizada para explicar a ocorrência da maioria das substâncias encontradas na natureza, e é aplicada principalmente para os elementos representativos. De acordo com a teoria do octeto, um grande número de átomos adquire estabilidade eletrônica quando apresenta oito elétrons na sua camada mais externa. Ao adquirir oito elétrons, o átomo assemelha-se à configuração estável de um gás nobre.
Quer entender mais sobre o que é a teoria do octeto? Então assista ao vídeo do Descomplica e fique fera!
Dica 2– Você acha difícil memorizar tudo que aprende? O Blog do Enem pode te ajudar! Acesse o link e descubra quais as dicas para você memorizar o que estudou. https://www.alunosonline.com.br/portugues/dicas-para-voce-memorizar-o-que-estuda.html
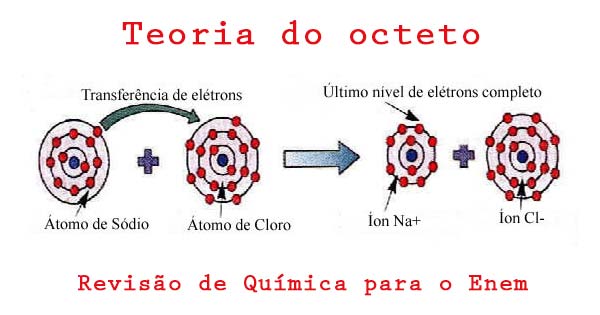
Para você entender melhor, observe o exemplo no Cloreto de Sódio (NaCl) na figura abaixo:
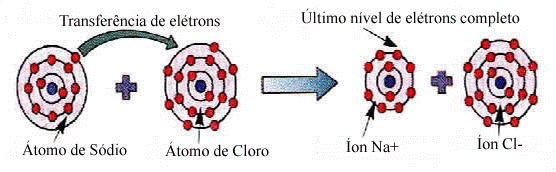
Ligação química entre o Sódio (Na) e o Cloro (Cl). A figura nos mostra como ocorre a ligação química entre o Na e o Cl:
1- O átomo de Sódio doa um elétron para o átomo de Cloro;
2- Forma-se o íon Na+com oito elétrons na camada de valência (última camada da eletrosfera);
3- O íon de cloro aparece com uma carga negativa (Cl–), indicando que recebeu um elétron e atingiu a estabilidade.
Dica 3 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares que é Ligações químicas. Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-enem-ligacoes-quimicas/
Mas como toda regra tem exceções… com a teoria do octeto não é diferente!
Hoje são conhecidos alguns compostos que não obedecem à regra do octeto:
- Em alguns casos, as ligações se completam com menos de 8 elétrons. Isso acontece com o berílio (Be) e o boro (B), que, em certas moléculas, não completam o octeto.
Exemplo:
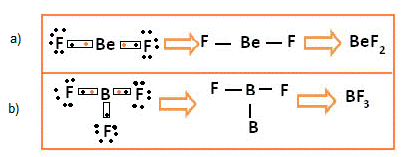
Exceção à regra do octeto dos elementos Berílio (a) e Boro (b)
No primeiro caso temos o difluoreto de berílio. Veja que apenas com duas ligações, isto é, com 4 elétrons na camada de valência, o berílio já atinge a estabilidade eletrônica.
Já no segundo caso, no trifluoreto de boro, o boro adquire estabilidade compartilhando seus três elétrons de valência com três átomos de flúor, assim ele fica estável com apenas 6 elétrons na camada de valência.
- Em outros casos, as ligações perfazem mais do que 8 elétrons. Ocorre geralmente com o fósforo (P) e o enxofre (S), que, em certas moléculas, aparecem com 10 e 12 elétrons na camada de valência.
Exemplo:
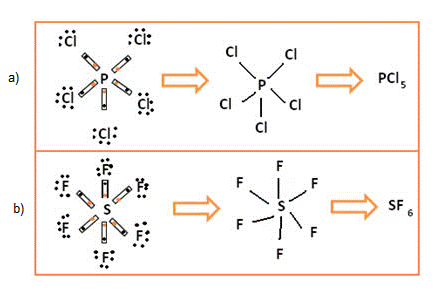
Exceção à regra do octeto dos elementos Fosforo (a) e Enxofre (b)
No primeiro caso, o fósforo ficou estável com 10 elétrons em sua camada de valência; já no segundo exemplo, o enxofre ficou com 12 elétrons.
Quer saber mais sobre as exceções a regra do octeto? Então assista ao vídeo do O Kuadro e tire de letra a prova do Enem e dos vestibulares de todo Brasil!
https://www.youtube.com/watch?v=UDXWUKy7Ww0
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.
Você consegue resolver este exercício? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
Considerando-se a ligação química entre o oxigênio e o alumínio, sob a luz da teoria do octeto, para a formação do óxido de alumínio, é CORRETO afirmar:
01. Cada átomo de alumínio perderá três elétrons.
02. O oxigênio será o ânion, com carga negativa igual a três para cada átomo.
04. Serão envolvidos dois átomos de alumínio na ligação.
08. Cada átomo de oxigênio receberá dois elétrons.
16. O número total de cargas positivas, por fórmula, será 6.
32. A configuração eletrônica do Al+3 será 1s² 2s² 2p6.
64. A fórmula mínima do óxido de alumínio conterá quatro átomos no total.
Resposta: V-F-V-V-F-V-F

