Ligações químicas são uniões estabelecidas entre átomos para formarem moléculas. Existem três tipos de ligações químicas: as iônicas, as covalentes e as metálicas. Veja!
Você sabe os tipos de ligações químicas estabelecidas entre os átomos para formar as moléculas? Lembra da regra do octeto? E por que existem tantos tipos de ligações? Então revise com as dicas da professora Munique Dias e com a videoaula do professor Felipe Sobis.
O que são ligações químicas
As ligações químicas são uniões estabelecidas entre átomos para formarem moléculas. Ou, no caso de ligações iônicas e metálicas, aglomerados atômicos organizados de forma a constituírem a estrutura básica de uma substância ou composto.
Mas a união estabelecida entre átomos não ocorre de qualquer forma. Para que uma ligação química ocorra, é necessário que haja condições apropriadas, tais como: afinidade, contato, energia, etc.
Regra do octeto ou porque as ligações químicas acontecem
Em 1916, Gilbert N. Lewis e Walter Kossel observaram que, na natureza, apenas os gases nobres (elementos da família 18, VIIIA ou 0 da tabela periódica) eram encontrados isolados na natureza.
 Gilbert N. Lewis e Walter Kossel
Gilbert N. Lewis e Walter Kossel
Isso acontecia porque eles tinham uma característica que os outros átomos não tinham: todos os elementos dessa família (com exceção do hélio, que tem apenas uma camada eletrônica) possuem a camada de valência de seus átomos preenchida com oito elétrons.
Associando essa observação com as ligações realizadas pelos átomos dos elementos das outras famílias da Tabela Periódica, eles criaram uma hipótese chamada de regra ou teoria do octeto, que está enunciada a seguir:
“Um átomo adquire estabilidade quando possui 8 elétrons na sua camada mais externa, ou 2 elétrons quando possui apenas uma camada”.
Tipos de ligações químicas
Existem três tipos de ligações químicas: a ligação iônica, a ligação covalente e a ligação metálica. Em seguida, vamos ver cada uma delas.
Ligação iônica
Como o próprio nome diz, a ligação iônica acontece entre íons. Assim, para que haja atração, esses íons deve ter cargas opostas. Além disso, é necessário que um elemento seja metal e que outro seja ametal.
Um exemplo de ligação iônica ocorre no NaCl (cloreto de sódio), que é formado pelo cátion Na+ e o ânion Cl–. Fazendo a distribuição eletrônica desses dois elementos, obteremos o seguinte:
| 11Na | 17Cl |
| 1s² | 1s² |
| 2s², 2p6 | 2s², 2p6 |
| 3s¹ | 3s², 3p5 |
Perceba que, enquanto o Na (sódio) possui 1 elétron na última camada, o Cl (cloro) possui 7 elétrons.
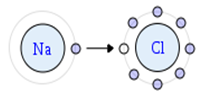
Dessa forma, se o sódio doar um elétron para o cloro, ambos ficarão com 8 elétrons em suas últimas camadas de valência. Assim, estabelecem uma ligação química iônica e passam a seguir a regra do octeto.
Para que você não precise fazer a distribuição eletrônica toda vez que se deparar com uma ligação iônica, você pode lembrar em qual família está localizado o elemento. Cada família já diz quantos elétrons um elemento tende a perder ou ganhar, ou seja, informam quantos elétrons estão na última camada.
Observe na imagem quantos elétrons estão na última camada em cada família:
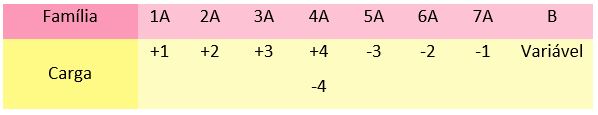
Perceba que os elementos da família 1A possuem carga +1, os da família 2A possuem +2, e assim sucessivamente. Apenas tome cuidado com a família 4A, que pode ter carga positiva ou negativa. Se o elemento da família 4A estiver ligado com um elemento positivo, sua carga será negativa e vice-versa.
Por fim, os elementos da família B podem variar suas cargas.
Ligação covalente
A ligação covalente é um tipo de ligação química que ocorre pelo compartilhamento de elétrons da camada de valência dos átomos envolvidos, formando pares eletrônicos. Cada par eletrônico é constituído por um elétron de cada átomo, sendo que na ligação química esses elétrons pertencem simultaneamente aos dois átomos.
Isso ocorre porque ligações covalentes só são feitas entre elementos ametais, ou seja, elementos que tendem a receber elétrons.
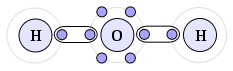
Um exemplo de ligação covalente é a que ocorre na molécula da água (H2O). O átomo de oxigênio necessita de dois elétrons para ficar estável e o hidrogênio irá compartilhar seu elétron com esse átomo. Sendo assim, o oxigênio ainda necessita de um elétron para se estabilizar, então é preciso de mais um hidrogênio, e esse,também compartilha seu elétron com o oxigênio, estabilizando-o.
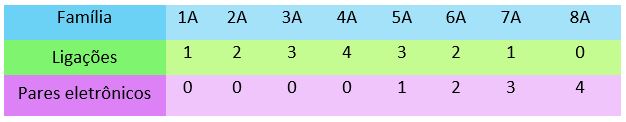
Da mesma forma que as ligações iônicas, podemos obter informações sobre as ligações covalentes a partir das famílias da tabela periódica. Por meio delas, podemos saber a quantidade de ligações que cada elemento pode fazer, e também quantos pares eletrônicos eles formam. Veja:
Videoaula
Para entender melhor as ligações iônicas e covalentes, e como essa tabela funciona, assista à videoaula do prof. Sobis:
Ligação metálica
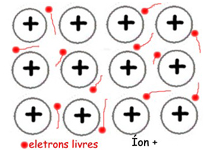
Por fim, a ligação metálica é aquela que ocorre entre metais, formando uma estrutura cristalina chamadas de “ligas metálicas” (união de dois ou mais metais). Nesse tipo de ligação química, os elétrons da última camada não ficam restritos ao respectivo átomo, mas circulam por todo o material. Esse modelo de ligação é conhecido como modelo do “mar de elétrons”, pois os cátions metálicos estão imersos nos elétrons livres.
Exercícios sobre ligações químicas
Para finalizar seus estudos, responda às questões sobre ligações químicas e veja como esse conteúdo cai no Enem e nos vestibulares.
1 – (ENEM/2019)
Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
a) 6
b) 8
c) 10
d) 12
e) 14
2- (PUC MG/2015)
Com base nas propriedades dos metais, assinale a afirmativa CORRETA.
a) Os metais formam ligações iônicas uns com os outros, denominadas de ligas metálicas.
b) As substâncias formadas por ligações metálicas possuem ponto de ebulição menor que as formadas por ligações iônicas, porque as ligações iônicas são mais fortes que as ligações metálicas.
c) Os metais não são bons condutores de calor e eletricidade.
d) O sódio metálico, ao ser colocado em contato com a água, sofre reação de modo a formar um composto iônico denominado hidróxido de sódio.
3- (FMJ SP/2013)
Um átomo neutro de um elemento químico apresenta um elétron na última camada. É correto afirmar que esse átomo
a) tem tendência a perder 2 elétrons para se estabilizar.
b) é um gás nobre.
c) pertence à família 2 da classificação periódica.
d) tem tendência a perder 1 elétron para se estabilizar.
e) pertence à família 5 da classificação periódica.
GABARITO:
- C
- D
- D



