Você lembra como são chamados os átomos com mesmo número de massa, mesmo número de elétrons e número atômico igual? O blog do Enem te ajuda a relembrar a Classificação dos Átomos. Vem com a gente!
Todos os átomos são formados pela mesma estrutura, um núcleo com os prótons e nêutrons e uma eletrosfera com os elétrons. Os átomos podem possuir o mesmo número de massa, de elétrons, de prótons e de nêutrons veja a seguir, como cada uma dessas situações é chamada:
A classificação dos átomos
- Isoeletrônicos: São os átomos que possuem a mesma quantidade de elétrons;
- Isóbaros: São os átomos que possuem o mesmo número de massa;
- Isotonos: São os átomos que possuem o mesmo número de neutros;
- Isotopos: São os átomos que possuem o mesmo número de prótons, mas, diferem na quantidade de nêutrons.
Cada tipo de átomo possui uma quantidade de prótons diferentes e com isso o elemento muda. Por exemplo, o átomo do hidrogênio possui número atômico igual a 1, pois ele tem apenas um próton em seu núcleo. Já o hélio possui dois elétrons e, assim, sucessivamente.
Observe o desenho abaixo, e siga no post para compreender e gravar bem: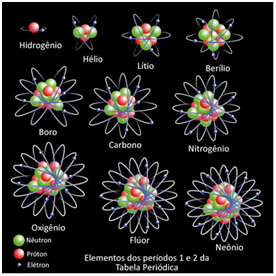
Como identificar o número de massa na divisão atômica
Para identificar um elemento químico fora da Tabela Periódica, costuma-se colocar o símbolo do elemento no centro, número de massa (A) na parte superior e o número atômico (Z) na parte inferior.
A figura abaixo mostra como isso pode ser feito para representar um elemento químico: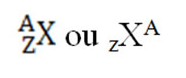 O número de massa é representado pela letra A e é a soma das partículas que estão no núcleo, ou seja os prótons mais neutrôns. A= P+N O número atômico (Z) é o número de prótons que existem no núcleo de um átomo qualquer. Esse número será igual ao de elétrons se o átomo for eletricamente neutro. Z = P = e
O número de massa é representado pela letra A e é a soma das partículas que estão no núcleo, ou seja os prótons mais neutrôns. A= P+N O número atômico (Z) é o número de prótons que existem no núcleo de um átomo qualquer. Esse número será igual ao de elétrons se o átomo for eletricamente neutro. Z = P = e

O que é Semelhança atômica
Essa é a semelhança atômica mais importante, pois praticamente todos os elementos químicos possuem isótopos naturais ou artificiais. Visto que possuem o mesmo número atômico, isso significa que átomos isótopos pertencem a um mesmo elemento químico. ![]() Por exemplo, o hidrogênio, conforme já mencionado, possui 1 próton apenas. Mas, na natureza, são encontrados três isótopos do hidrogênio, que são:
Por exemplo, o hidrogênio, conforme já mencionado, possui 1 próton apenas. Mas, na natureza, são encontrados três isótopos do hidrogênio, que são:
11H 12H 13H
prótio ou deutério ou trítio ou
hidrogênio comum hidrogênio pesado hidrogênio superpesado
A descoberta dos isótopos
1913 – J.J. Thomson observou que gases quimicamente puros apresentam valores distintos para a relação carga/massa(q/m) e que para um mesmo gás essa relação é constante. Aperfeiçoando as técnicas de medição, Thomson observou um fato notável: o neônio, um gás de massa 20,2, comportava-se como uma mistura de gases de massas 20 e 22. Ele constatou este fenômeno pois apareciam desvios diferentes no tubo de descargas. Como a carga (q) do neônio é constante, Thomson deduziu que esse gás quimicamente puro é constituído por átomos de mesma carga, porém de massa diferentes.
Aperfeiçoando as técnicas de medição, Thomson observou um fato notável: o neônio, um gás de massa 20,2, comportava-se como uma mistura de gases de massas 20 e 22. Ele constatou este fenômeno pois apareciam desvios diferentes no tubo de descargas. Como a carga (q) do neônio é constante, Thomson deduziu que esse gás quimicamente puro é constituído por átomos de mesma carga, porém de massa diferentes.
A divisão da classificação dos átomos
Em 1919, o cientista inglês Francis Willian Aston (1877-1945) aperfeiçoou a aparelhagem de Thomson, de quem foi discípulo, inventando o primeiro espetrógrafo de massa. Com esse aparelho, Aston demonstrou com maior clareza a existência de átomos de um mesmo elemento, com massas diferentes, deixando claro o fato de o neônio ser formado de átomos quimicamente iguais, porém com massas diferentes.
Tais formas de um elemento foram denominadas pelo cientista inglês Frederick Soddy (1877-1956) de isótopos, do grego isso = mesmo; topos = lugar.
 Nesse caso, trata-se de elementos químicos diferentes, pois o número atômico não é igual. Exemplos: 1737Cl e o 2040Ca.
Nesse caso, trata-se de elementos químicos diferentes, pois o número atômico não é igual. Exemplos: 1737Cl e o 2040Ca.
Para descobrirmos o número de nêutrons desses elementos e sabermos se eles são mesmo isótonos, basta diminuir o número de massa (A – na parte superior) pelo número de prótons (na parte inferior):
1737Cl 2040Ca
A = N + P A = N + P
N = A – P N = A – P
N = 37-17 N = 40 – 20
N = 20 N = 20
 Esses átomos também são de elementos químicos diferentes.
Esses átomos também são de elementos químicos diferentes.- Exemplo: 1940K e o 2040Ca (A = 40).
 Um exemplo que podemos citar é entre o átomo de neônio (1020Ne) e o cátion de sódio (1123Na+1).
Um exemplo que podemos citar é entre o átomo de neônio (1020Ne) e o cátion de sódio (1123Na+1).
Observe que o neônio está no estado fundamental, ou seja, ele é neutro, o que significa que possui a mesma quantidade de prótons e elétrons. Na sua parte inferior é mostrado o número de prótons, portanto, podemos concluir que ele possui 10 elétrons.
Videoaula
Veja mais alguns exemplos dos isótopos, isótonos e isóbaros assistindo a videoaula do Kuatro. Se liga! Esse assunto é muito cobrado nas questões de química dos vestibulares de todo o Brasil e também na prova do Enem.
 Esses átomos também são de elementos químicos diferentes.
Esses átomos também são de elementos químicos diferentes.