As Ligações Covalentes são aquelas em que ocorre compartilhamento de elétrons, quando na reação os elétrons envolvidos na ligação química passam a "pertencer" aos dois átomos ligados. Essa interação permite a formação de moléculas. Revise as ligações covalentes para arrebentar nas questões de Química do Enem e dos vestibulares!
Os elementos químicos podem interagir entre si realizando ligações químicas. Dependendo de como os átomos interagem, teremos diferentes tipo de ligações químicas. Neste post iremos revisar as ligações covalentes. Você sabe como elas ocorrem? Não? Então acompanhe esta aula para arrebentar nas questões de Química do Enem e dos vestibulares!
Antes de falarmos propriamente das ligações covalentes, é importante que você conheça um pouquinho sobre o químico Lewis. Este cientista nasceu nos Estados Unidos em 1875 e foi professor de Química na Universidade de Berkeley na Califórnia.
Lewis se destacou ao estudar as interações entre os átomos e criou a teoria das ligações covalentes imaginando elétrons orientados em certas direções, nas quais formariam ligações químicas (1916). Talvez você lembre também que Lewis criou uma maneira bem didática para representar os elétrons da camada de valência de um átomo (aquela onde as ligações ocorrerão), onde cada elétron é representado por um bolinha em volta do símbolo químico do elemento.
Talvez você lembre também que Lewis criou uma maneira bem didática para representar os elétrons da camada de valência de um átomo (aquela onde as ligações ocorrerão), onde cada elétron é representado por um bolinha em volta do símbolo químico do elemento.
Segundo o químico Lewis, ligação covalente ou molecular é aquela que se dá por compartilhamento de elétrons, ou seja, os elétrons envolvidos na ligação química passam a “pertencer” aos dois átomos ligados. Essa interação permite a formação de moléculas. Lembre-se de que chamamos de molécula o conjunto de átomos unidos ligações químicas – como as covalentes.
A ligação covalente, geralmente é feita entre os não-metais e não metais, hidrogênio e não-metais e hidrogênio com hidrogênio.
Como se da essa ligação? Veja o exemplo. Observe o elemento Cloro: Na ligação entre os dois átomos de cloro, ambos precisam de um elétron para se estabilizar.
Na ligação entre os dois átomos de cloro, ambos precisam de um elétron para se estabilizar.
Nesse caso, forma-se um par de eletrônico para o qual cada um dos átomos de cloro fornece um elétron, que passa a ser compartilhado pelos dois átomos.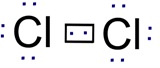 Fórmula eletrônica ou fórmula de Lewis para a molécula de cloro.
Fórmula eletrônica ou fórmula de Lewis para a molécula de cloro.
Após a ligação, o par de elétrons passa a pertencer aos dois átomos que, então, passam a ter 8 elétrons cada um, no último nível. O conjunto formado constitui a molécula Cloro e ela é eletricamente neutra. Ou seja, não há predomínio de cargas positivas ou negativas e como não houve a transferência de elétrons, não há íons.
Dica 1– Para compreender melhor as ligações covalentes, é importante que você compreenda bem a Teoria do Octeto. Para relembrar esta teoria, acesse esse excelente post da professora Munique Dias.
Aula Gratuita de Ligações Covalantes
Veja agora com o professor Sobis, do canal Curso Enem Gratuito, um super resumo para você aprender de vez as Ligações Químicas Covalentes e também as Ligações Iônicas. Vem!
Gostou da aula do Professor Sobis? Boa demais!!! Veja agora a Fórmula Estrutural:
Veja a Fórmula Estrutural das Ligações Covalentes
Além da fórmula de Lewis, também é utilizada a formula estrutural, em que cada par eletrônico comum é representado por um traço (-), e a fórmula molecular, na qual o símbolo é acompanhado do número de átomos que participa da molécula. Mas, como toda regra tem exceção… Fique atento(a) às exceções à regra do octeto:
Mas, como toda regra tem exceção… Fique atento(a) às exceções à regra do octeto:
Exceções à regra do octeto
Em alguns casos, as ligações se completam com menos de 8 elétrons. Isso acontece com o berílio (Be) e o boro (B), que em certas moléculas, não completam o octeto:
- Na molécula BeH2, o berílio se estabiliza com apenas 4 elétrons na sua última camada.
- Na molécula BF3, ele está estabilizado com apenas 6 elétrons na sua camada de valência.
Em outros casos, as ligações perfazem mais do que 8 elétrons. Ocorre geralmente com o fósforo (P) e o enxofre (S) que, em certas moléculas, aparecem com 10 e 12 elétrons na camada de valência.
- Na molécula PCl5, o fósforo se estabiliza com 10 elétrons na sua última camada.
- Na SF5, existem 12 elétrons estabilizando o enxofre.
Esses casos só ocorrem quando o átomo central é relativamente grande, para que possa acomodar tantos elétrons ao seu redor. Por isso, esse caso só aparece para elementos a partir do 3º período da Tabela Periódica.
Dica 2– Reveja também outro assunto muito importante para a prova do Enem e dos vestibulares que é os modelos atômicos. Acesse o nosso blog do Enem e veja um super-resumo preparado pela professora Munique Dias. Vai ficar de fora dessa?
Para finalizar sua revisão e entender mais sobre as Ligações Covalentes, assista a videoaula do professor Paulo Valim e fique fera no assunto!
E agora? Que tal testar seu conhecimento? Você consegue resolver este exercício?
(PUC – PR) Dados os compostos:
I – Cloreto de sódio
II – Brometo de hidrogênio
III – Gás carbônico
IV – Metanol
V – Fe2O3
Apresentam ligações covalentes os compostos:
- a) I e V
b) III e V
c) II, IV e V
d) II, III e IV
e) II, III, IV e V
Resposta: d





