Veja agora o essencial para você resolver as questões de Termoquímica no Enem. Quem acerta uma questão desse conteúdo já arranca na frente. Confira Entalpia, Calor Sensível, Calor Latente, e as Formas de Energia para mandar bem nas provas.
A termoquímica é o estudo dos processos de transferência de energia que ocorrem durante as transformações químicas e algumas transformações físicas. É conteúdo de Físico-Química que cai direto nas provas do Enem.
As diversas formas de energia estão em alta nas provas no mundo todo. A sociedade está em busca de novas formas de energia que sejam mais sustentáveis e menos poluidoras.
Formas de Energia
- Energia potencial (Epot ): relacionada à posição relativa de corpos.
- Energia cinética (Ecin): relacionada ao movimento de corpos.
- Energia interna (U): SEcin, Epot de átomos, moléculas, etc. que constituem um corpo.
Introdução à Termoquímica
Confira agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, o que é a Entalpia, e veja os processos básicos da Termoquímica para você resolver as questões do Enem.
As dicas do Felipe Sobis:
- Termoquímica é a parte da química que estuda as quantidades de calor liberados ou absorvidos, durante uma reação química.
- O conceito fundamental para você mandar bem na Termoquímica é dominar o que é a Entalpia.
- Nas reações químicas ocorrem tanto a ruptura como a formação de ligações intramoleculares, ou seja, das ligações químicas.
- As reações em que ocorre a liberação de energia são chamadas de exotérmicas.
- As reações em que ocorrem absorção de energia, são chamadas endotérmicas.
- Para determinarmos se um processo é exotérmico ou endotérmico, devemos considerar a energia absorvida para a ruptura das ligações dos reagentes e a energia liberada para a formação das ligações dos produtos.
- O saldo energético entre elas indica se o processo libera ou absorve energia.
Fatores que afetam a entalpia de uma reação:
- 1 – Quantidade em mol de produtos e reagentes.
- 2 – Estado físico de produtos ou reagentes.
- 3 – Estado alotrópico de produtos ou reagentes. (alótropos = substância simples diferentes, formadas pelo mesmo elemento químico).
- 4 – Temperatura. Altas temperaturas fornecem reações endotérmicas e vice-versa.
Entenda o que é a Entalpia
Entalpia (H) – transferência de calor a pressão constante.
- Obs.: reações realizadas em sistemas abertos ocorrem a pressão praticamente constante igual à pressão atmosférica.
- Reações que ocorrem dentro do nosso corpo ocorrem a volume constante e pressão variável.
Reações Exotérmicas ou Endotérmicas
- Exotérmicas – são reações que liberam calor (ΔH < 0). Os produtos são mais estáveis que os reagentes.
- Endotérmicas – são reações que absorvem calor (ΔH > 0). Os reagentes são mais estáveis que os produtos.
Entenda a Lei de Hess. É básico na Termoquímica
Confira agora com a professora Larissa, do canal do Curso Enem Gratuito.
O químico suíço Germain Henry Hess (1802 – 1850), em seus estudos, verificou que o calor liberado ou absorvido em uma reação química depende dos estados iniciais presentes nos reagentes e do estado final presente nos produtos, independente do caminho seguido pela reação química. Veja no resumo acima com a professora Larissa.
Transformações e Conservação de Energia
 As transformações da energia em suas diferentes formas são muito comuns no nosso dia-a-dia.
As transformações da energia em suas diferentes formas são muito comuns no nosso dia-a-dia.
1ª Lei da Termodinâmica: a energia total do universo deve ser conservada.
- Sistema: parte do universo que está sendo estudada
- Vizinhanças: restante do universo
- Sistema + Vizinhanças = universo
- Limite: separa o sistema e vizinhanças
- ΔU = q + ω
- A variação da energia interna de um sistema é resultado de transferência de energia na forma de calor e trabalho.
- Observação importante:
- se energia flui para dentro do sistema, o sinal é positivo (+)
- se energia flui para fora do sistema, o sinal é negativo (-)
- q > 0: o calor flui para dentro do sistema
- q < 0: o calor flui para fora do sistema
- w > 0: o trabalho é realizado sobre o sistema
- w < 0: o trabalho é realizado pelo sistema
Unidade de energia
Joule (J) ou Calorias (Cal)
1Cal= 4,184 J
Calor
Fluxo de energia devido à diferença de temperatura entre dois corpos. O calor flui sempre do corpo mais quente para o mais frio.
O calor é diretamente proporcional ao Grau de agitação molecular
Transferência de energia na forma de calor
Trabalho (w)
Qualquer transferência de energia diferente de calor. Ex: trabalho de expansão de um gás, trabalho elétrico, etc.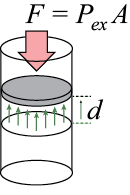 Trabalho de expansão de um gás: w = P .ΔV
Trabalho de expansão de um gás: w = P .ΔV
Entalpia e mudanças de fase
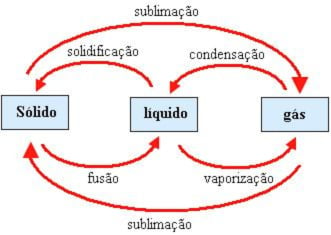
Nas mudanças de fase em que as moléculas ficam mais separadas, é necessário fornecer energia, logo DH > 0, são processos endotérmicos.
Ex: DHvap, DHfus
Nas mudanças de fase em que as moléculas ficam mais unidas, energia é liberada, logo DH < 0, são processos exotérmicos.
Ex: DHsol, DHcond
OBS.: DHvap = – DHcond
DHfus = – DHsol
etc…
DHvap > DHfus
Fatores que influenciam o ΔH de uma reação
- Estado físico dos reagentes e produtos.
H2(g) + 1/2 O2(g) → H2O(g) ΔH = -57,8 kcal/mol
H2(g) + 1/2 O2(g) → H2O(l) ΔH = -68,3 kcal/mol
- Temperatura em que a reação ocorre.
A quantidade de calor deve ser somada ou subtraída da entalpia da reação em obediência ao princípio de conservação de energia.
- Pressão em que a reação ocorre
- Pressões muito altas alteram o valor de ΔH para reações em fase gasosa.
- Quantidade de matéria
Ex.:
H2(g) + Cl2(g) →2HCl(g) ΔH = -44,2 kcal/mol
2H2(g) + 2Cl2(g) → 4HCl(g) ΔH = -88,4 kcal/mol
- Presença ou não de solvente.
Os Tipos de calor
Calor sensível– provoca apenas variação de temperatura (grau de agitação molecular muda). É calculado pela equação abaixo, onde Q é o calor sensível, m a massa do corpo e ΔT é a variação de temperatura.
Q = m . c .ΔT
Calor latente – provoca alteração no estado físico do corpo (separação entre as moléculas). É calculado pela equação abaixo, onde Q é o calor latente, m a massa do corpo e L é o calor latente (J/g) da transformação. L depende do composto e da transformação física.
Q = m . L
Exercícios sobre termoquímica
Questão 1
(UFSM)
A água
A água é uma das mais importantes substâncias do planeta Terra, tanto para os processos vitais como para os físico-químicos. No estado líquido e sólido, cobre mais de dois terços do pleneta e, na forma gasosa, é constituinte da atmosfera. Os organismos vivos originaram-se em meio aquoso e se tornaram dependentes dele no decurso da evolução. A água é o solvente universal, pois possibilita a maioria das reações químicas. Assim, o conhecimento de suas propriedades físico-químicas é essencial para o estudo de suas funções na natureza.
REICHARDT, K, TIMM, L. C. Solo, Planta e Atmosfera: conceitos, processos e aplicações. São Paulo: Ed. Manole, 2004. (adaptado)
Considerando a reação abaixo:
2H2(g) + O2(g) 2H2O(g)
2H2O(g)
A respeito do diagrama de entalpia:
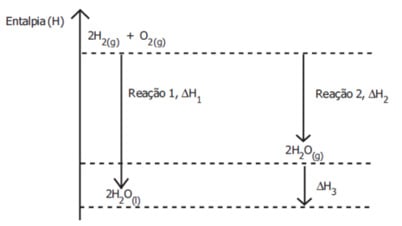
Pode-se afirmar que:
a) a entalpia da H2O(l) é maior que a das substâncias simples formadoras.
b) O ΔH1 é característico de uma reação endotérmica.
c) o ΔH2 é característico de uma reação que libera calor.
d) a reação 2 é mais endotérmica que a reação 1.
e) a ΔH3 corresponde à entalpia de vaporização da água.
Dica 1 – Revise tudo sobre os Principais compostos orgânicos e inorgânicos em mais esta aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/principais-compostos-organicos-e-inorganicos-quimica-enem/
Questão 2 de Termoquímica
A figura abaixo representa o diagrama de energia da reação de combustão do etanol.
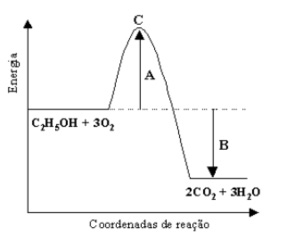
I- A representa a energia de ativação;
II- B representa a variação de entalpia;
III- C representa a formação do produto da reação;
IV- A reação é exotérmica;
V- A diminuição da temperatura aumenta a velocidade da reação.
Assinale a alternativa correta:
a) todas as afirmativas são verdadeiras.
b) somente as afirmativas III e IV são verdadeiras.
c) somente as afirmativas I, II e IV são verdadeiras.
d) somente as afirmativas I, II e V são verdadeiras.
e) somente as afirmativas III e V são verdadeiras.
Dica 2 – Revise sobre a classificação e a nomenclatura dos Óxidos em mais esta aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/oxidos-quimica-enem
Questão 3 – Termoquímica
Ao se dissolver uma determinada quantidade de soda cáustica (NaOH) em água a 25ºC, observa-se uma solução cuja temperatura foi de 45ºC. A transformação descrita caracteriza um processo do tipo:
a) atérmico.
b) adiabático.
c) isotérmico.
d) exotérmico.
e) endotérmico.
Gabarito das questões de Termoquímica:
- C
- C
- E



