Veja Hidrocarbonetos, Funções Halogenadas, Funções Oxigenadas e Funções Nitrogenadas na Química Orgânica. E, confira os Ácidos e Bases na Química Inorgânica
Dominar as características, a classificação e as propriedades dos Principais Compostos Orgânicos e Inorgânicos pode ajudar você a fazer pontos preciosos no Enem e nos Vestibulares.
Os compostos orgânicos estão vinculados à presença do elemento Carbono. No campo dos Compostos Inorgânicos estão os Sais (Ácidos; Bases; e os Óxidos).
A Química Orgânica separa as substâncias orgânicas por classes de acordo com a semelhança entre seus comportamentos químicos. Os compostos orgânicos estão na base da vida na terra.
A Classes determinadas pela participação dos Átomos de Carbono são chamadas de Funções Orgânicas. Veja também o que são os Hidrocarbonetos, as Funções Halogenadas, as Funções Oxigenadas, e as Funções Nitrogenadas.
Como reconhecer as funções orgânicas:
Cada função orgânica possui um conjunto de elementos característicos, que são átomos ou grupos de átomos responsáveis pelas propriedades químicas e físicas comuns das substâncias em cujas moléculas estão presentes, conhecidos como grupos funcionais.
Eles estão nos compostos orgânicos.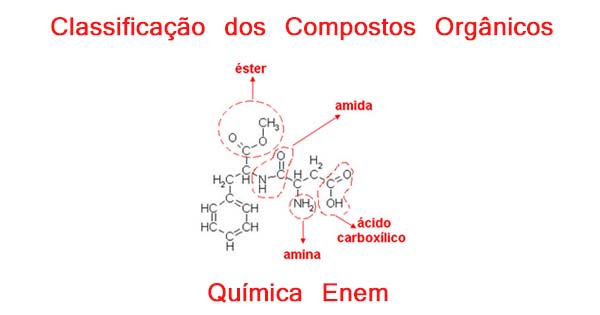 Grupo funcional é o tipo de átomo ou grupo de átomos que caracteriza uma função química.
Grupo funcional é o tipo de átomo ou grupo de átomos que caracteriza uma função química.
Resumo Gratuito das Funções Orgânicas:
Veja com o professor Felipe Sobis, do canal Curso Enem Gratuito, um resumo simples e rápido sobre os Compostos Orgânicos. É a base para você entender as Funções Orgânicas:
Excelente esta aula do Sobis. Veja agora os Hidrocarbonetos;
Os Hidrocarbonetos
- Os Hidrocarbonetos são bastante numerosos, encontrados principalmente no petróleo. Eles podem ser classificados como:
- Alcanos
- Alcenos
- Alcinos
- Ciclano
- Aromático
As Funções Halogenadas:
- Haletos de alquila
- Haletos de arila
As Funções Oxigenadas
- São as funções orgânicas representadas pelos grupos funcionais que contêm oxigênio:
- Álcoois
- Fenol
- Eter
- Adeídos
- Cetona
- Ácido Carboxílico
- Éster
A Nomenclatura dos Compostos Orgânicos Hidrocarbonetos
Veja no resumo com o professor Sobis as dicas para você não errar nas questões com os nomes dos compostos orgânicos.
Muito boas as dicas do Sobis. Vamos seguir adiante!
Funções Nitrogenadas
As funções nitrogenadas possuem átomos de carbono, hidrogênio, nitrogênio, e, às vezes, oxigênio.
- · Aminas
- · Amidas
- · Nitrilas
- · Nitrocompostos.
Muitas substâncias orgânicas apresentam dois ou mais grupos funcionais em suas moléculas, essas substâncias são classificadas como funções mistas.
Um exemplo de composto de função mista é o aspartame, um adoçante que é 200 vezes mais doce que o açúcar.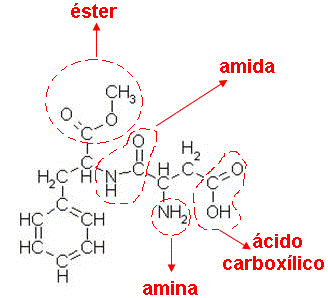 Aspartame: exemplo de composto orgânico de função mista. – Fonte: http://mundoeducacao.bol.uol.com.br/quimica/nomenclatura-compostos-com-funcoes-mistas.htm
Aspartame: exemplo de composto orgânico de função mista. – Fonte: http://mundoeducacao.bol.uol.com.br/quimica/nomenclatura-compostos-com-funcoes-mistas.htm
Veja os Principais compostos orgânicos:
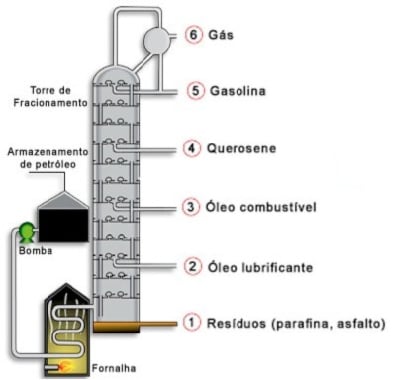
- Petróleo (composto natural) – é um líquido oleoso, escuro, formado por milhares de compostos orgânicos (principalmente hidrocarbonetos). Quanto mais hidrocarbonetos, mais fácil o refino do petróleo.
- Veja na imagem a Destilação Fracionada do Petróleo:

O Petróleo costuma ser dividido em:
- base parafínica – quando mais de 90% da composição é de alcanos.
- base asfáltica – quando predominam hidrocarbonetos de elevado ponto de ebulição (usados para fazer asfato).
- base naftalênica – quando 15% a 20% da composição é referente a cicloalcanos (hidrocarbonetos naftalênicos).
- base aromática – quando 25 a 30% da composição é referente a hidrocarbonetos aromáticos.
Gás natural – é uma mistura gasosa, formada por 70 a 90% de metano (CH4), 0,5 a 7% de etano (C2H6), outros hidrocarbonetos (propano e butano em pequenas quantidades) bem como contaminantes (H2S e CO2 (responsáveis pela corrosão de escapamentos de automóveis), N2, etc.).
Hulha ou carvão-de-pedra – é um carvão mineral, encontrado em geral entre 400 a 1000m de profundidade.
Dica do Blog > Quando aquecida a aproximadamente 1000ºC, a hulha produz 4 frações principais:
- Gás hulha – H2, CH4, CO- usado como fonte de gás hidrogênio ou como combustível.
- Águas amoniacais – NH4OH e seus sais, o qual quando reage com H2SO4 produz (NH4)2SO4 (usado em adubos).
- Alcatrão da hulha – benzeno e derivados, fenóis, compostos aromáticos policíclicos (naftaleno, antraceno, etc.), piche, etc.
- Carvão coque – carbono de alta pureza, usado como agente redutor em metalúrgicas.
Compostos Sintéticos a partir do Nafta:
– Na indústria petroquímica – a partir do craqueamento e outros processos, o nafta (fração do petróleo) é transformado em:
- Polietileno (polímero (plástico) usado em embalagens, brinquedos, etc.);
- Polipropileno (polímero usado em fitas, tapetes, etc.);
- Borrachas sintéticas (pneus, etc.);
- Corantes (tintas);
- Explosivos;
- Poliéster (tecidos, etc.).
– Indústria carboquímica – a partir da hulha ou do acetileno (química do acetileno) são obtidos diversos compostos sintéticos:
- Policloreto de vinila (PVC);
- Poliacetato de vinila (plástico PVA);
- Poliacrilonitrila (fios têxteis) – Orlon e crylon;
- Ácido acético;
- Cloropreno (borracha sintéticas);
- Solventes clorados (não inflamáveis) – dicloroetileno; tetracloroetano.
Os Compostos Inorgânicos:
Você já estudou acima que as substâncias químicas podem ser agrupadas entre orgânicas e inorgânicas. E, já acompanhou o resumo sobre os Compostos Orgânicos. Agora, para fixar bem: Os compostos Inorgânicos são aquelas substâncias que não contêm carbono em sua composição: Ácidos; Bases; e Óxidos.  Importante: Mas, não se engane! Lembre-se de que também são consideradas inorgânicas algumas substâncias que contêm carbono, como o dióxido de carbono, monóxido de carbono, grafite, diamante, ácido carbônico, ácido cianídrico, e os sais carbonatos e cianetos.
Importante: Mas, não se engane! Lembre-se de que também são consideradas inorgânicas algumas substâncias que contêm carbono, como o dióxido de carbono, monóxido de carbono, grafite, diamante, ácido carbônico, ácido cianídrico, e os sais carbonatos e cianetos. ![]() Você lembra qual são as definições de ácidos e bases? Então fique atento! Cai na FUVEST, no Enem, no Encceja e na maioria dos vestibulares.
Você lembra qual são as definições de ácidos e bases? Então fique atento! Cai na FUVEST, no Enem, no Encceja e na maioria dos vestibulares.
Ácidos e bases: Definições de Arrhenius, Bronsted-Lowry e Lewis:
1 – Arrhenius:
- Ácidos são Substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+).
- Bases são Substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
2 – Bronsted-Lowry:
- Ácido é uma substância capaz de ceder um próton a uma reação
- Base é uma substância capaz de receber um próton.
3 – Lewis
- Ácidos são substâncias que em numa ligação química, podem receber pares eletrônicos
- Bases são substâncias que cedem pares eletrônicos
Dica 1 – Ácidos e Bases com aulas em vídeo da Khan Academy: Quer ver um super- resumo sobre ácidos e bases e mandar muito bem na prova do Enem, da Fuvest e de outros vestibulares? Acesse este resumo completo com dicas da professora Munique Dias e vídeos da Khan Academy: https://blogdoenem.com.br/enem-acidos-bases/
Vamos relembrar como identificar ácido e base?
É possível medir a concentração de hidrogênio iônico em uma solução a partir de uma escala logarítmica inversa, que recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala de pH.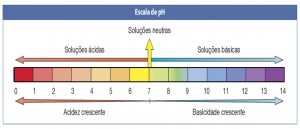 Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases).
Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases).
Dica 2 – Vamos relembrar como calcular o pH de ácidos forte a bases? Veja uma revisão completa com e vídeo aulas do Khan do Professor Toid e também dicas da professora Munique Dias https://blogdoenem.com.br/quimica-enem-calculo-ph-poh/
E a nomenclatura dos ácidos e das bases? Você lembra? Não se preocupe, o blog do Enem relembra para você não fazer feio nas provas da FUVEST, dos vestibulares ou do Enem.
As Reações Inorgânicas – Resumo completo sobre Ácidos e Bases
Veja agora a classificação e a denominação dos Ácidos e das Bases
A NOMENCLATURA DOS ÁCIDOS
Os ácidos podem ser divididos em dois grupos: que contém oxigênio (oxigenados) e os que não contêm (não oxigenados).
Ácidos não oxigenados ou hidrácidos Exemplos:
Exemplos:
- HF – ácido fluorídrico HCl – ácido clorídrico
- HBr – ácido bromídrico HI – ácido iodídrico
- H2Se – ácido selenídrico H2Te – ácido telenídrico
Ácidos oxigenados ou oxiácidos
Quando forma apenas um oxiácido, segue a regra geral:
Ácido + nome do ânion + ico
Se formar mais de um oxiácido com Nox (número de oxidação) diferentes acrescenta-se os prefixos per ou hipo e os sufixos iço ou oso.
Exemplos:
HClO4 (Nox do cloro = +7; 4 átomos de oxigênio): ácido perclórico
HClO3 (Nox do cloro = +5; 3 átomos de oxigênio): ácido clórico – ácido padrão
HClO2 (Nox do cloro = +3; 2 átomos de oxigênio): ácido cloroso
HClO (Nox do cloro = +1; 1 átomo de oxigênio): ácido hipocloroso
Aula Gratuita sobre Ácidos e Bases
Agora, uma nova chance para você revisar mais uma vez e aprender de vez a nomenclatura dos ácidos. É uma videoaula do Kuadro. Confira, e nunca mais erre a questão de nomenclatura dos ácidos!
Muito boa esta aula!
NOMENCLATURA DAS BASES: Exemplos:
Exemplos:
NaOH – Hidróxido de sódio
Ferro → Fe2+ e Fe3+
Fe2+ Fe(OH)2 = Hidróxido de ferro (II) ou hidróxido ferroso.
Fe3+: Fe(OH)3 = Hidróxido de ferro (III) ou hidróxido férrico.
Principais compostos inorgânicos
- Nitrogênio – compõe aproximadamente 78% da atmosfera. Está presente também nos seres vivos (nas proteínas), na natureza é encontrado principalmente no salitre-do-chile (NaNO3).
É preparado industrialmente pela destilação do ar líquido ou através da reação abaixo.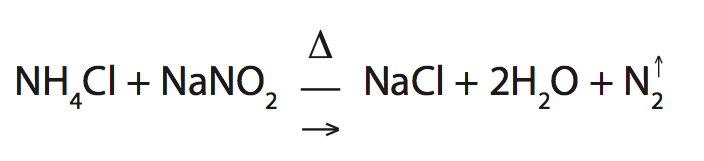
Processo de transformação do gás nitrogênio
N2 → NH3 → NO → NO2 → HNO3 → explosivos, corantes, plásticos, nitratos (adubos), nitrito, etc.
Oxigênio – é um gás incolor, inodoro, não inflamável, mas comburente.
É obtido pela destilação fracionada do ar atmosférico ou industrialmente por reação de hidrólise da água.
Por ser muito reativo (oxidante), forma óxidos com a maioria dos elementos químicos.
Hidrogênio – é um gás incolor, inodoro, não venenoso, menos denso que o ar e altamente inflamável.
Na indústria, é produzido por:
- Eletrólise de solução aquosa de NaCl;
- Queima de carbono e água formando o gás de água (CO e H2);
- A partir do petróleo (craqueamento (quebra) de hidrocarbonetos);
- Oxidação de metais com ácidos (HCl, H2SO4, HNO3), ou seja, reação de oxirredução de metais com ácidos inorgânicos.
Metais alcalinos
A denominação de Metais Alcalinos é dada aos Elementos Químicos da família 1 ou 1A da tabela periódica.
O mais importante é o sódio obtido pela eletrólise ígnea de NaCl. O Na é altamente reativo e perigoso (pega fogo em contato com ar e água) e deve ser guardado sob querosene.
Ele é usado em muitas reações orgânicas para a obtenção de: corantes, perfumes, medicamentos, cianeto de sódio, peróxidos, produção de “lâmpadas de sódio” (iluminação de ruas (luz amarela)), etc.
Metais alcalinos terrosos
Metais da família 2 ou 2A da tabela periódica.
- Magnésio – metal leve (pouco denso), obtido através da eletrólise ígnea do MgCl2.
- Devido a sua baixa densidade, é usado em muitas ligas metálicas para uso na indústria aeroespacial.
- Por ser facilmente oxidado, também é usado como metal de sacrifício (evita oxidação de outros metais.
- O Mg(OH)2 é usado para diminuir a acidez do estômago.
- Cálcio – metal leve, obtido através da eletrólise ígnea do CaCl2. Ele é mais reativo que o magnésio.
- Principais compostos de cálcio: CaO (cal virgem); CaCO3 (carbonato de cálcio).
- Carbono – grafite, diamante e carvão. Compostos orgânicos.
- Enxofre – é abundante na natureza na forma de S8, sulfetos (FeS (pirita), etc.) e sulfatos (CaSO4.2H2O, gipsita, etc.). Está presente em alta concentração no núcleo da terra (FeS) e consiste um dos principais contaminantes do petróleo (logo que o H2Sé corrosivo).
- Halogênios
- Flúor (CaF2, fluorita, etc.). É obtido pela eletrólise do HF. Altamente reativo (devido à eletronegatividade);
- Cloro – é obtido pela eletrólise em solução aquosa de NaCl. Muito reativo, explode em contato com hidrogênio.
- Principais compostos: HCl, NaClO, NaClO3.
- Usado como branqueador em indústria do papel, alvejantes, bactericida no tratamento de água e esgotos, etc.
- Bromo – é obtido da água do mar (MgBr2). Extremamente reativo. É usado na produção de desinfetantes, corantes, medicamentos, produção de HBr e AgBr (usado em filmes fotográficos antigos).
- Iodo – é obtido do NaIO3. É o halogênio menos reativo. É usado com desinfetante (em cirurgias, etc.), produção de corantes, medicamentos, tinturas, sal de cozinha (controle da tiroide (hipertireoidismo, bócio)).
Processos de obtenção de minerais
Mineral é todo constituinte natural da crosta terrestre.
Principais tipos de minerais:
- óxidos – SiO2, Fe2O3;
- Sulfetos – PbS, FeS2;
- oxi-sais – CaCO3; MgCO3; Silicatos e alumínio silicatos (K2O.Al2O3.6SiO2).
- Minério – é o mineral que permite a extração de certos elementos ou compostos químicos (principalmente óxidos e sulfetos de metais).
- Para a obtenção de ferro – hematita (Fe2O3) e limonita (2Fe2O3.3H2O);
- Para a obtenção de alumínio – bauxita (Al2O3.2H2O);
- Para a obtenção de cobre – cuprita (CuS) e calcopirita (CuFeS2);
- Para a obtenção de chumbo – galena (PbS).
- Mineração – é o processo da extração do minério que se encontra na natureza.
- Metalurgia – é o processo de extração de um metal a partir de um minério.
Resumo
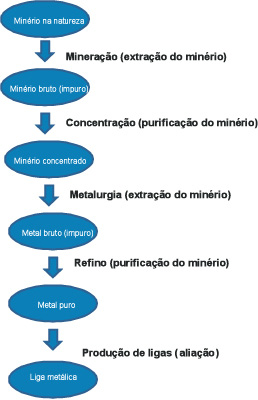
Principais ligas metálicas
- Aço inoxidável: liga Fe + C + Cr + Ni
- Aço para trilho: liga Fe + C + Mn
- Aço para ferramentas de corte: liga Fe + C + W + Mo
- Aço para imãs: liga de Fe + C + Al + Ni + Co
- Bronze: liga Cu + Al
- Duralumínio: liga Al + Cu + Mg
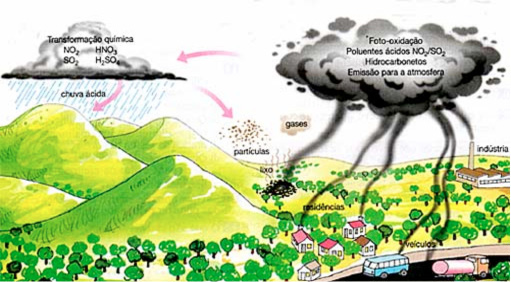
Chuva ácida
A chuva ácida ocorre quando óxidos ácidos, principalmente compostos azotados (NOx, óxidos de nitrogênio) e óxidos de enxofre (SOx), produzidos na queima de combustíveis fósseis, reagem com a umidade do ar (água) formando ácidos. Como os ácidos diminuem muito o pH da água, a chuva resultante dé chamada chuva ácida.
Principais problemas da chuva ácida:
- Pode destruir florestas acabando com os nutrientes do solo (altera pH do solo, vital à vida nele);
- Resulta na corrosão de metais entre outros materiais (mármore, objetos históricos, obras de arte, etc.);
- Altera o pH da água dos rios, mares, etc., alterando a vida marinha.
O Efeito estufa
É um processo onde a radiação infravermelha emitida pela terra é absorvida por gases (principalmente gás carbônico) na atmosfera.
Essa retenção de radiação na atmosfera provoca um maior grau de agitação das moléculas de ar, ou seja, aumenta a temperatura da atmosfera.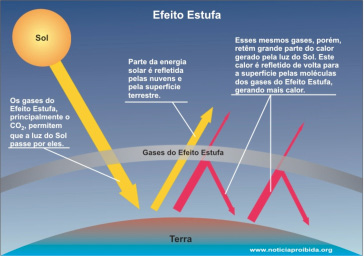
Destruição da camada de ozônio
A Camada de ozônio (O3) é uma barreira natural de gases que atuam evitando a passagem de radiação ultravioleta (UVA, UVB e UVc), principal causadora de câncer de pele.
Os gases CFCs (Cloro Flúor Carbono) são os principais causadores da destruição da camada de ozônio. 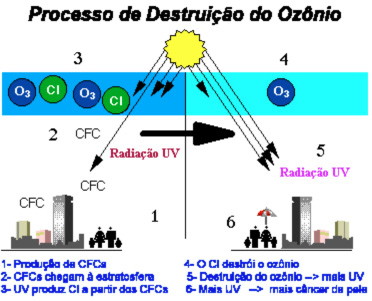 Com a destruição da camada de ozônio, os raios ultravioletas (mutagênicos) não serão retidos, o que resultará num grande aumento de casos de câncer de pele.
Com a destruição da camada de ozônio, os raios ultravioletas (mutagênicos) não serão retidos, o que resultará num grande aumento de casos de câncer de pele.
Poluição da água, ar e do solo
O ar, a água e o solo são vitais aos seres humanos, logo sem eles seria impossível a vida na terra. Eles podem ser contaminados de diversas formas:
- Desmatamento;
- Pela acumulação de lixos e detritos;
- Pelo lançamento de forma incorreta de esgotos domésticos e industriais no solo e na água;
- Por resíduos industriais tóxicos;
- Pelo uso de agrotóxicos, herbicidas, pesticidas, entre outros compostos químicos usados na agricultura;
- Por contaminação de resíduos nucleares (contaminam ar, água e solo). Ex.: Japão após maremoto e explosões nas usinas nucleares;
- Naufrágios de navios petroleiros;
- Queima de combustíveis fósseis;
- Dejetos de animais jogados no solo e na água podem contaminar os alimentos.
Saiba mais sobre Principais compostos orgânicos e inorgânicos nestas aulas dos canais Aula De e Descomplica, disponíveis no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
[youtube http://www.youtube.com/watch?v=lxocZhg6JJM]
[youtube http://www.youtube.com/watch?v=e3M9LezMxRY]
Desafios
Questão 1
(UFSM)
Com relação aos efeitos sobre o ecossistema, pode-se afirmar que:
I- As chuvas ácidas poderiam causar a diminuição do pH da água de um lago, o que acarretaria a morte de algumas espécies, rompendo a cadeia alimentar.
II- As chuvas ácidas poderiam provocar a acidificação do solo, o que prejudicaria o crescimento de certos vegetais.
III- As chuvas ácidas causam danos se apresentarem valores de pH maior que o da água destilada.
Dessas afirmativas está(ão) correta(s):
a) I apenas;
b) III apenas;
c) I e II apenas;
d) II e III apenas;
e) I e III apenas.
Dica 1 – Revise sobre a classificação e a nomenclatura dos Óxidos em mais esta aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/oxidos-quimica-enem
Questão 2
(ENEM)
“O ferro pode ser obtido a partir da hematita, minério rico em óxido de ferro, pela reação com carvão e oxigênio. A tabela, a seguir, apresenta dados da análise de minério de ferro (hematita) obtido de várias regiões da Serra de Carajás.”
|
Minério da região |
Teor de enxofre (S) / % em massa |
Teor de ferro (Fe) / % em massa |
Teor de silica (SiO2 ) / % em massa |
|
1 |
0,019 |
63,5 |
0,97 |
|
2 |
0,020 |
68,1 |
0,47 |
|
3 |
0,003 |
67,6 |
0,61 |
No processo de produção do ferro, dependendo do minério utilizado, forma-se mais ou menos SO2, um gás que contribui para o aumento da acidez da chuva. Considerando esse impacto ambiental e a quantidade de ferro produzida, pode-se afirmar que seria mais conveniente o processamento do minério da(s) região(ões):
a) 1 apenas;
b) 2 apenas;
c) 3 apenas;
d) 1 e 3 apenas;
e) 2 e 3 apenas.
Dica 2 – O Exame Nacional do Ensino Médio está chegando! Revise tudo sobre Bases: Definição de Arrhenius em mais esta aula de Química Enem – https://blogdoenem.com.br/bases-definicao-de-arrhenius-quimica-enem/
Questão 3
(ENEM)
A possível escassez de água é uma das maiores preocupações da atualidade, considerada por alguns especialistas como o desafio maior do novo século. No entanto, tão importante quanto aumentar a oferta é investir na preservação da qualidade e no reaproveitamento da água de que dispomos hoje.
A ação humana tem provocado algumas alterações quantitativas e qualitativas da água:
I- Contaminação de lençóis freáticos;
II- Diminuição da umidade do solo;
III- Enchentes e inundações.
Pode-se afirmar que as principais ações humanas associadas às alterações I, II e III são respectivamente:
a) Uso de fertilizantes e aterros sanitários/ desmatamento/ impermeabilização do solo urbano.
b) Uso de fertilizantes e aterros sanitários/ lançamento de gases poluentes/ canalização de córregos e rios.
c) Lançamento de gases poluentes/ lançamento de lixo nas ruas/ construção de aterros sanitários.
d) Lançamento de lixo nas ruas/ uso de fertilizantes/ construção de aterros sanitários.
e) Construção de barragens/ uso de fertilizantes/ construção de aterros sanitários.
Dica 3 – Revise sobre Funções inorgânicas em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio! – https://blogdoenem.com.br/funcoes-inorganicas-quimica-enem-2/
Questão 4
(ENEM)
Boa parte da água utilizada nas mais diversas atividades humanas não retorna ao ambiente com qualidade para ser novamente consumida. O gráfico mostra alguns dados sobre esse fato, em termos dos setores de consumo.
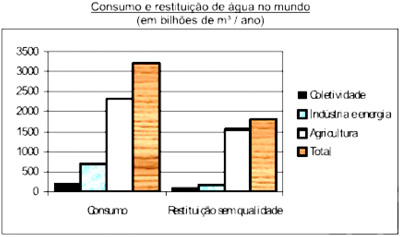
Fonde: Adaptado de MARGAT, Jean-François. A água ameaçada pelas atividades humanas. In WIKOWSKI, N. (Coord). Ciência e tecnologia hoje, São Paulo: Ensaio, 1994.
Com base nesses dados, é possível afirmar que:
a) mais da metade da água usada não é devolvida ao ciclo hidrológico.
b) as atividades industriais são as maiores poluidoras de águas.
c) mais da metade da água restituída sem qualidade para o consumo contém algum teor de agrotóxico ou adubo.
d) cerca de um terço do total da água restituída sem qualidade é proveniente das atividades energéticas.
e) o consumo doméstico, dentre as atividade humanas, é o que mais consome e repõe água com qualidade.
Questão 5
(ENEM)
Moradores de três cidades, aqui chamadas de X, Y e Z, foram indagados quanto aos tipos de poluição que mais afligiam as suas áreas urbanas. Nos gráficos abaixo estão representadas as porcentagens de reclamações sobre cada tipo de poluição ambiental.
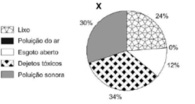
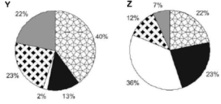
Considerando a queixa principal dos cidadãos de cada cidade, a primeira medida de combate à poluição em cada uma delas seria, respectivamente:
a) Manejamento de lixo, Esgotamento sanitário, Controle na emissão de gases.
b) Controle de despejo industrial, Manejamento de lixo, Controle na emissão de gases.
c) Manejamento de lixo, Esgotamento sanitário, Controle de despejo industrial.
d) Controle na emissão de gases, Controle de despejo industrial, Esgotamento sanitário.
e) Controle de despejo industrial, Manejamento de lixo, Esgotamento sanitário.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
 Exemplos:
Exemplos:
