Você lembra o que é uma transformação isobárica? Não? O Blog do Enem te ajuda a relembrar para você mandar bem na prova do Enem e dos vestibulares de todo o Brasil. Estude com a gente!
Essa transformação também recebe o nome de Lei de Charles e Gay-Lussac. No século XVIII, o físico francês Jacques Alexandre César Charles descobriu essa relação entre volume e temperatura. Em 1987 ele formula a lei da proporção direta entre volume e a temperatura de um gás a pressão constante. Essa conclusão foi comprovada experimentalmente por Joseph Louis Gay-Lussac no inicio do século XIX, sendo então oficialmente publicada.

Dica 1 – O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/.
ISSO (igual) + BARICA (pressão)

Resumindo a lei de Charles e Gay-Lussac pode ser enunciada como:
“QUANDO UMA PRESSÃO DE UMA AMOSTRA DE GÁS PERMANECE CONSTANTE, A SUA TEMPERATURA E DIRETAMENTE PROPORCIONAL AO SEU VOLUME”.
Veja mais sobre as transformações isobáricas assistindo ao vídeo do professor Sobis do Curso Enem Gratuito e mande bem na prova do Enem e dos vestibulares de todo o Brasil. Não deixe de assistir!
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/.
Veja um diagrama de uma transformação isobárica:
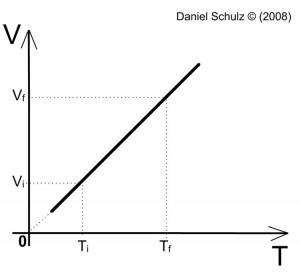
Você pode observar a proporcionalidade da temperatura em relação ao volume, pois, à medida que a temperatura aumenta o volume também aumenta!
Podemos expressar matematicamente essa relação como:
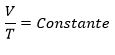
Onde essa constante depende da temperatura em que ocorre a transformação da amostra do gás confinado no recipiente. Essa relação também pode ser descrita ainda de outra forma. Se a amostra de gás, a uma pressão inicial pi, ocupando o volume Vi, passar a ter pressão pf e volume Vf, mantendo sempre a temperatura constante, pode-se afirmar que:
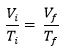
Dica 3 – Reveja também outro assunto que está relacionado com as transformações isobáricas que são as transformações isotérmicas Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/revisao-de-quimica/.
Vamos ver um exemplo:
“Certa massa gasosa ocupa um volume de 800 cm3 a -23ºC, em uma dada pressão. Qual é a temperatura registrada quando a massa gasosa, na mesma pressão, ocupar um volume de 1,6 L?”
Resolução:
Dados:
Vinicial = 800 cm3
Tinicial = -23 ºC
Vfinal = 1,6 L
Tfinal = ?
* Primeiro temos que deixar o volume na mesma unidade. Sabe-se que 1 dm3 equivale a 1 litro. Como um 1 dm3 é o mesmo que 1 000 cm3, sabe-se que 1 litro = 1 000 cm3:
1 L —– 1000 cm3
x——– 800 cm3
x = 0,8 L
* Agora, substituímos os valores da fórmula e encontramos o valor da temperatura final:
Vinicial = Vfinal
Tinicial Tfinal
0,8_ = 1,6
(-23) Tfinal
0,8 Tfinal =- 23 . 1,6
Tfinal = – 36,8
0,8
Tfinal = – 46 ºC
* Passando para a escala em Kelvin, temos:
T (K) = T (ºC) + 273
T (K) = -46 + 273
T (K) = 227 K
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.