Vem com a gente revisar transformações gasosas! Aprenda Química para se dar bem no Enem!
Um gás pode sofrer três transformações distintas: isobárica, isovolumétrica ou isotérmica, você lembra o porquê dessas transformações? Vamos revisar? O Blog do Enem te ajuda a mandar bem na prova do Enem e dos vestibulares de todo Brasil. Não deixe de estudar!
Ao longo dos séculos, os cientistas estudaram as transformações provocadas por variações de pressão, volume e temperatura em uma massa fixa de gás. Essas transformações podem ocorrer com temperatura constante (isotérmica), pressão constante (isobárica) e volume constante (isocórica ou isovolumétrica). Vamos relembrar cada uma delas?
Só pra saber… O prefixo “iso” vem do grego isos e significa “igual”
Transformação isotérmica ou Lei de Boyle
Essa transformação acontece quando a temperatura do gás permanece constante com variação do volume e da pressão. Ela foi estudada por Robert Boyle (1627 – 1691) quando observou que dobrando a pressão em uma massa fixa de gás, seu volume cai pela metade.. ![]() Mas, como assim?
Mas, como assim?
Significa que quando a pressão aumenta, o volume do gás diminui proporcionalmente, ou seja, se a pressão aumentar 2 vezes, o volume do gás diminuirá 2 vezes.
Exemplo de uma transformação isotérmica ou Lei de Boyle Fonte: http://brasilescola.uol.com.brEntão, podemos expressar a relação entre a pressão e o volume, para gases em condições ideais, pela seguinte equação.
P.V = constante (em condições ideias)
A representação gráfica de uma transformação isotérmica será sempre uma hipérbole. Essa hipérbole é chamada de isoterma. Veja no gráfico a representação gráfica de uma transformação isotérmica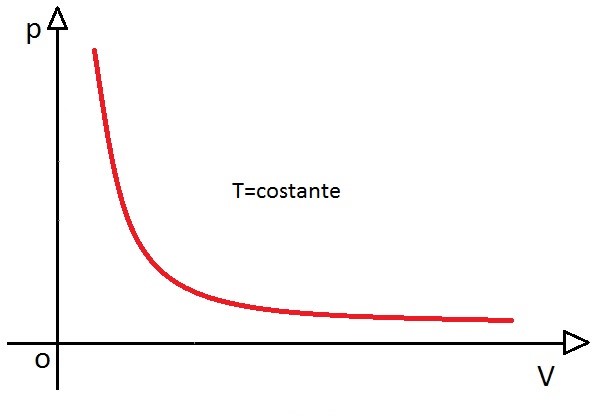
Transformação isocórica ou Lei de Gay-Lussac
Essa transformação foi observada em 1787, pelo físico francês Jacques Charles que estudou e relação entre a pressão e a temperatura de uma massa fixa de um gás sob volume constante e observou que, quando se dobrava a temperatura, a pressão do gás também dobrava.
Vamos entender melhor…
Isso ocorre porque a pressão é resultado das colisões das partículas do gás com as paredes do recipiente, assim, quanto mais colisões, maior será a pressão. Se a temperatura aumentar, a energia cinética das partículas também aumentará e elas se movimentarão com maior velocidade, aumentando a pressão.
A Pressão e a temperatura se relacionam através da seguinte equação:
P/V = constante (em condições ideias)
A transformação isocórica é representada graficamente por uma reta: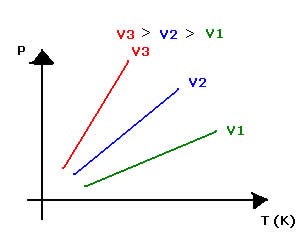
Representação gráfica de uma transformação isocórica
Dica 2 – Reveja também outro assunto muito importante para a prova do Enem e dos vestibulares que é Modelo dos gases ideais.
Transformação isobárica
Em 1802, Joseph Louis Gay-Lussac, ao estudar o comportamento do volume e da temperatura de uma massa fixa de gás sob pressão constante, observou que o volume era diretamente proporcional à temperatura. Isso significa que, nessas condições, quando a temperatura de um gás dobra, seu volume também dobra.
Entendeu? Observe a figura abaixo…
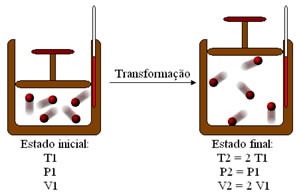
Através da figura 4 podemos observar que ao dobramos a temperatura T1 ( T2 = 2.T1) de uma massa fixa de gás a uma pressão constante, o volume do gás também dobra ( V2 = 2.V1), representando assim, uma transformação isocórica.
Essa transformação é representada pela seguinte equação:
V/P = constante (em condições ideias)
A transformação isobárica é representada graficamente por uma reta, pois, quando a temperatura aumenta, o volume também aumentará proporcionalmente.
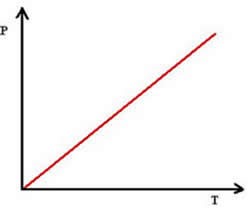
Dica 3 – Relembre outros assuntos de química acessando o nosso blog e gabarite as questões de química nas provas dos vestibulares e do Enem.
Entenda mais sobre as transformações gasosas assistindo a videoaula do Química do Enem e fique fera! Não deixe de assistir!
Para finalizar sua revisão, faça o exercício que selecionei para você:
(OSEC-SP) Um carro-tanque transportou gás cloro para uma estação de tratamento de água. Sabe-se que o volume do tanque que continha gás cloro era de 30 m3, que a temperatura era mantida a 20oC para a pressão ser de 2 atm e que, na estação de tratamento de água, esse cloro foi transferido para um reservatório de 50 m3 mantido a 293 K. Ao passar do carro-tanque para o reservatório, o gás sofreu uma transformação……..e a pressão do reservatório era………….. As lacunas são completamente preenchidas, respectivamente, com os dados:
a) isotérmica, 1,2 atm.
b) isométrica, 117 atm.
c) isobárica, 2 atm.
d) isocórica, 2 atm.
e) isovolumétrica, 1,2 atm.
Resposta: a
Curso Enem Gratuito
Quer aumentar suas chances no próximo Exame Nacional do Ensino Médio e mandar bem nas Notas de Corte do Enem? Estude com as apostilas e aulas gratuitas do Curso Enem Online. Todas as matérias do Exame e ainda as Dicas de Redação. Acesse aqui o Curso Enem Gratuito.





