Ácidos, bases, sais e óxidos. Entenda como são constituídas as funções inorgânicas e saiba como não errar as suas nomenclaturas nesta aula de Química Enem
Entenda o que são as Funções Inorgânicas no mundo da Química. Cai sim no Enem e nos vestibulares. São os compostos que não têm o Elemento Carbono em sua composição. Os ácidos, as bases, os sais e os óxidos fazem parte do universo das Funções Inorgânicas.
Ácidos (Arrhenius)
Definição: espécie química que libera como único cátion o íon H+ em solução aquosa. ![]() Exemplos: HCℓ, H2SO4, H3BO3, H2S.
Exemplos: HCℓ, H2SO4, H3BO3, H2S. ![]() Características dos Ácidos: apresentam sabor azedo, conduzem corrente elétrica, quando adicionados ao mármore e a outros carbonatos, produz efervescência, com liberação de gás carbônico.
Características dos Ácidos: apresentam sabor azedo, conduzem corrente elétrica, quando adicionados ao mármore e a outros carbonatos, produz efervescência, com liberação de gás carbônico.  Antes de se dissolverem em água os ácidos são compostos moleculares.
Antes de se dissolverem em água os ácidos são compostos moleculares.
 Produtos industrializados, medicamentos, frutas consumidas no cotidiano que apresenta determinada acidez. Fonte: http://quimicasemproblemas.blogspot.com
Produtos industrializados, medicamentos, frutas consumidas no cotidiano que apresenta determinada acidez. Fonte: http://quimicasemproblemas.blogspot.com
 Ácidos orgânicos são a defesa de alguns insetos. Fonte: www.brasilescola.com
Ácidos orgânicos são a defesa de alguns insetos. Fonte: www.brasilescola.com
Na presença da água:
a) ácido clorídrico
HCl(aq) → H+(aq) + Cl–(aq)
b) ácido nítrico
HNO3(aq) → H+(aq) + NO3–(aq)
Classificação dos Ácidos:
Quanto à presença do elemento oxigênio.
• Oxiácidos: apresentam o elemento oxigênio. Exemplos: H2SO4, H3BO3.
• Hidrácidos: não apresentam o elemento oxigênio. Exemplos: H2S, HCℓ, HCN.
Nomenclatura: para nomear um ácido não-oxigenado basta escrever o nome do elemento acrescido da terminação ídrico.
(nome do elemento) + ídrico
Ex: HF = ácido fluorídrico
HCl = ácido clorídrico
HBr = ácido bromídrico
H2S = ácido sulfídrico
HCN = ácido cianídrico
Ácidos oxigenados ou oxiácidos
Há várias maneiras de nomear os ácidos que contêm oxigênio.
Uma delas é utilizando o número de oxidação (NOX) do elemento central.
|
Nox |
Nome |
|
+7 |
per … ico |
|
+6 +5 |
… ico |
|
+4 +3 |
… oso |
|
+2 +1 |
hipo … oso |
Dica 1 – As Ligações Químicas acontecem entre os átomos dos elementos. Entendas as regras que determinam os tipos de ligações nesta aula de Química Enem – https://blogdoenem.com.br/revisao-sobre-ligacoes-quimicas-quimica-enem/
Bases ou Hidróxidos (Arrhenius)
Definição: é toda substância que, em solução aquosa, libera como íon negativo somente OH-.
Características: Possui sabor adstringente e conduz corrente elétrica. As propriedades comuns entre as bases se devem ao íon negativo OH-.

Fonte: http://www.profpc.com.br

Fonte: http://www.magmablog.com

Algumas bases estão presente em medicamentos, produtos de higiene, produtos de limpeza. Fonte: http://www.brasilescola.com
Abaixo segue a dissociação do hidróxido de sódio.
NaOH(s) → Na+(aq) + OH–(aq)
Nomenclatura: o nome das bases é obtido a partir dos cátions presentes na molécula.
Hidróxido de … (nome do cátion)
Ex: NaOH – Hidróxido de sódio
Dica 2 – Para gabaritar em Química Enem, entenda como relacionar as propriedades químicas e físicas dos elementos dentro da Tabela Periódica – https://blogdoenem.com.br/propriedade-periodica-elementos-enem/
Sais
Definição: são todas as substâncias que em água sofrem dissociação produzindo pelo menos um cátion diferente de H+ e pelo menos um ânion diferente de OH–. São compostos que contêm pelo menos um cátion da base e um ânion de um ácido.



Os mais variados tipos de sais são utilizados no tratamento de água, como condimento, fermento para massas, complementos minerais entre outras aplicações. Fontes: www.nortonmellopersonal.com
|
NaOH |
+ |
HCl |
NaCl |
+ |
H2O |
|
|
base |
ácido |
sal |
água |
Nomenclatura: a nomenclatura dos sais depende da presença ou ausência do elemento oxigênio.
• Sais desoxigenados:
Nome do elemento + sufixo (eto)
Exemplo: NaCl = cloreto de sódio
• Sais oxigenados:
O sufixo depende do NOX do elemento central.
|
Nox |
Nome |
|
+7 |
per … ato |
|
+6 +5 |
… ato |
|
+4 +3 |
… ito |
|
+2 +1 |
hipo … ito |
Óxidos
Definição: são substâncias binárias onde o elemento oxigênio é o mais eletronegativo. Exemplos: Na2O, Cl2O, CaO, CO2.
Classificação dos óxidos:
• Quanto à natureza
– Iônicos: presença de metais em sua composição. Elementos das famílias 1A, 2A, 3A ou do grupo B. Exemplos: CaO, Na2O, K2O, MgO.
– Covalentes: presença apenas de ametais na composição. Apenas famílias 4A, 5A, 6A, 7A e H. Exemplos: CO2, CO, N2O, N2O4.
• Quanto ao caráter
– Básico: São os óxidos iônicos. Exemplos: Na2O, CaO, MgO.
Principais exceções (Anfóteros): Al2O3, ZnO.
– Ácidos: São os óxidos covalentes. Exemplos: CO2, SO2, SO3.
Principais exceções: CO, NO, N2O.
Dica 3 – Metais alcalinos, calcogênios, halogênios e gases nobres. Revise nesta aula de Química Enem, como é fácil localizar os elementos químicos na Tabela Periódica – https://blogdoenem.com.br/tabela-periodica-quimica-enem/
Desafios
Questão 01
Numa rodovia pavimentada, ocorreu o tombamento de um caminhão que transportava ácido sulfúrico concentrado. Parte da sua carga fluiu para um curso d’água não poluído que deve ter sofrido, como conseqüência:
I. mortandade de peixes acima da normal no local do derrame de ácido e em suas proximidades.
II. variação do pH em função da distância e da direção da corrente de água.
III. danos permanentes na qualidade de suas águas.
IV. aumento momentâneo da temperatura da água no local do derrame.
É correto afirmar que, dessas conseqüências, apenas podem ocorrer
a) I e II.
b) II e III.
c) II e IV.
d) I, II e IV.
e) II, III e IV.
Questão 02
Uma região industrial lança ao ar gases como o dióxido de enxofre e óxidos de nitrogênio, causadores da chuva ácida. A figura mostra a dispersão desses gases poluentes. Considerando o ciclo da água e a dispersão dos gases, analise as seguintes possibilidades:
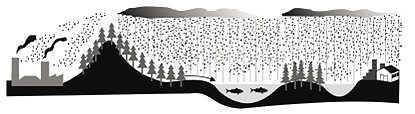
I. As águas de escoamento superficial e de precipitação que atingem o manancial poderiam causar aumento de acidez da água do manancial e provocar a morte de peixes.
II. A precipitação na região rural poderia causar aumento de acidez do solo e exigir procedimentos corretivos, como a calagem.
III. A precipitação na região rural, embora ácida, não afetaria o ecossistema, pois a transpiração dos vegetais neutralizaria o excesso de ácido.
Dessas possibilidades:
a) pode ocorrer apenas a I.
b) pode ocorrer apenas a II.
c) podem ocorrer tanto a I quanto a II.
d) podem ocorrer tanto a I quanto a III.
e) podem ocorrer tanto a II quanto a III.
Questão 03
O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala abaixo.
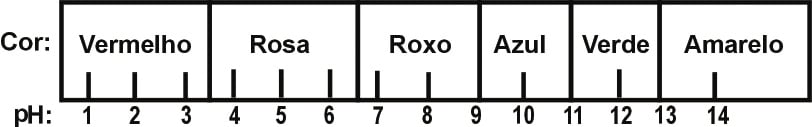
Algumas soluções foram testadas com esse indicador, produzindo os seguintes resultados:
|
Material |
Cor |
|
|
I |
Amoníaco |
verde |
|
II |
Leite de magnésia |
azul |
|
III |
Vinagre |
vermelho |
|
IV |
Banana verde |
amarelo |
De acordo com esses resultados, as soluções I, II, III e IV têm, respectivamente, caráter:
a) ácido/básico/básico/ácido.
b) ácido/básico/ácido/básico.
c) básico/ácido/básico/ácido.
d) ácido/ácido/básico/básico.
e) básico/básico/ácido/básico
Questão 04
(Enem – adaptado) Suponha que um agricultor esteja interessado em fazer uma plantação de girassóis. Procurando informação, leu a seguinte reportagem:
Solo ácido não favorece plantio
Alguns cuidados devem ser tomados por quem decide iniciar o cultivo do girassol. A oleaginosa deve ser plantada em solos descompactados, com pH acima de 5,2 (que indica menor acidez da terra). Conforme as recomendações da Embrapa, o agricultor deve colocar, por hectare, 40kg a 60kg de nitrogênio, 40kg a 80kg de potássio e 40kg a 80kg de fósforo. O pH do solo, na região do agricultor, é de 4,8. Dessa forma, o agricultor deverá fazer a “calagem”.
(Folha de S. Paulo, 25/09/1996)
Suponha que o agricultor vá fazer calagem (aumento do pH do solo por adição de cal virgem – CaO). De maneira simplificada, a diminuição da acidez se dá pela interação da cal (CaO) com a água presente no solo, gerando hidróxido de cálcio (Ca(OH)‚), que reage com os íons H+ (dos ácidos), ocorrendo, então, a formação de água e deixando ions Ca+2 no solo.
Considere as seguintes equações:
I. CaO + 2H2O → Ca(OH)2
II. CaO + H2O → Ca(OH)2
III. Ca(OH)2 + 2H+ → Ca+2 + 2H2O
IV. Ca(OH)2 + H+ → CaO + H2O
O processo de calagem descrito pode ser representado pelas equações:
a) I e II
b) I e IV
c) II e III
d) II e IV
Questão 05
(UFMG) Na embalagem de um produto usado para desentupir pias e ralos, à base de soda cáustica (hidróxido de sódio – NaOH), são encontradas, entre outras, as instruções:
Cuidado: Em caso de contato, lavar imediatamente os olhos ou a pele com água em abundância durante quinze minutos. Se ingerido, não provocar vômito. Dar grande quantidade de água e também vinagre diluído em um copo de água. A seguir, dar uma colher de óleo comestível.
Não reaproveitar a embalagem vazia. Lavar a colher utilizada como medida com bastante água corrente antes de reutilizá-la. Não adicionar água à embalagem do produto. O quadro abaixo relaciona algumas dessas instruções com as justificativas para o uso desses procedimentos, com base nas propriedades da soda cáustica e das outras espécies envolvidas.
Assinale a alternativa que contém uma justificativa incorreta para a instrução relacionada.
a) Instrução: Dar vinagre diluído em um copo de água. Justificativa: O vinagre diluído neutraliza a soda cáustica através de reação ácido-base.
b) Instrução: Lavar a colher utilizada como medida com bastante água corrente antes de reutilizá-la. Justificativa: A utilização de grande quantidade de água deve-se ao fato de a soda cáustica ser insolúvel na água.
c) Instrução: Não adicionar água à embalagem com o produto. Justificativa: A adição de água à embalagem com o produto provoca forte aquecimento.
d) Instrução: Não reaproveitar a embalagem vazia. Justificativa: A embalagem pode estar contaminada com resíduos de soda cáustica.