É hora de rever CNTP e os fatores que influenciam na velocidade das reações químicas: Temperatura, Pressão, Catalisador, Inibidor, Luz, Superfície de Contato, e Concentração. Venha revisar Cinética Química para garantir sua nota no Enem.
Cinética Química – Você lembra das ‘Condições Normais de Temperatura e Pressão’, a famosa sigla CNTP? Se ficou em dúvida, o melhor é revisar para não vacilar depois e perder pontos. Vamos lá, bem do começo: Cinética Química é o estudo da velocidade das reações química e os fatores que a alteram.
Há reações químicas praticamente instantâneas, e outras que demoram horas e mesmo dias para se concluírem. Reações com ácidos e bases, por exemplo, podem ser muito rápidas, quase instantâneas. Já a formação de rochas pode durar muitos anos.
A Cinética Química
Por outro lado, um palito de fósforo acende em segundos. Uma vela queima durante horas.

Fatores que influenciam na velocidade das reações – Os principais fatores que influenciam na velocidade das reações são: Temperatura, Pressão, Catalisadores, Inibidores, Superfície de Contato, Concentração (dos reagentes), e Presença (ou ausência) de Luz.
Resumo sobre a Cinética Química:
Saiba mais sobre Cinética Química na aula do professor Felipe Sobis, do canal do Curso Enem Gratuito. Ele é um campeão da Química na Internet:
Muito bom este resumo do professor Felipe Sobis. Vale a pena ver de novo antes de continua no resumo escrito.
Os fatores na Velocidade das Reações
Para você compreender como estes fatores influenciam a velocidade das reações: O aumento da Temperatura acelera as reações; O aumento da Pressão provoca mais colisões entre as moléculas, o que também pode aumentar a velocidade das reações.
Os Catalisadores são exatamente ‘aceleradores’ ou ‘facilitadores’ das reações, e contribuem para a maior velocidade; A maior Superfície de Contato e a maior Concentração dos reagentes também contribui para aumentar a velocidade;
Os Inibidores, já pelo próprio nome, reduzem a velocidade das reações e a influência da Luz depende muito do tipo de reação que está ocorrendo, e tanto pode aumentar quanto reduzir a velocidade.
A Velocidade das Reações Químicas
Velocidade média de uma reação: é o quociente da variação da concentração molar (molaridade (mol/L)) de uma das substâncias dividida pela variação de tempo.
Observe esta representação de uma reação, e veja como entender a Cinética Química através dela: aA + bB → cC + dD
Consumo: A e B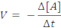
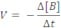
Formação: C e D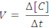
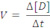
onde Δ = concentração final menos a concentração inicial
Velocidade da reação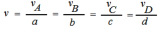
Equação da velocidade (medida experimentalmente)
Considerando a reação:
aA + bB → cC + dD
V = K [A]n . [B]m
Onde:
n = ordem da reação em relação à A
m = ordem da reação em relação à B
Para reações elementares (ocorrem em apenas uma etapa):
V = K[A]a . [B]b
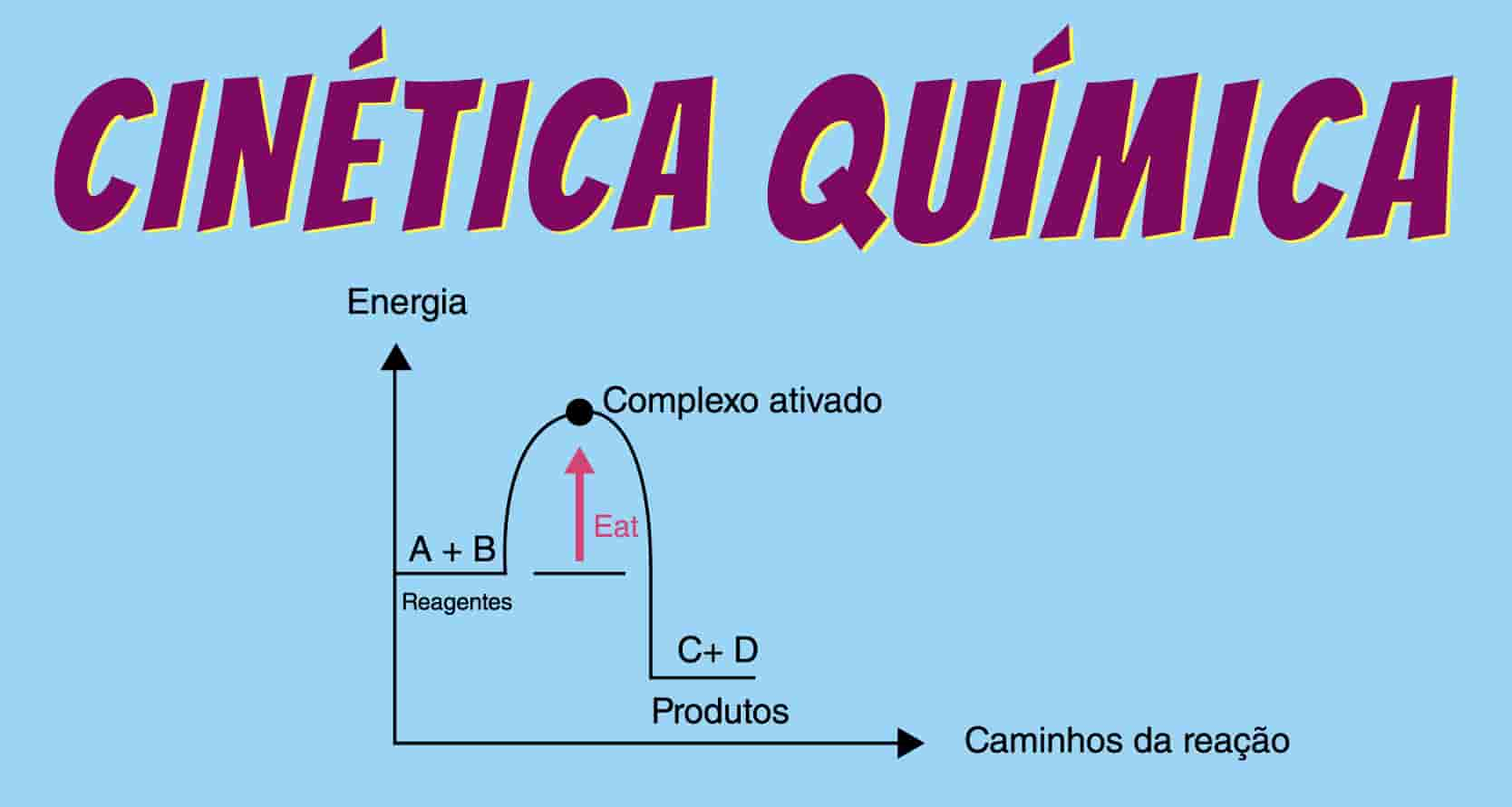
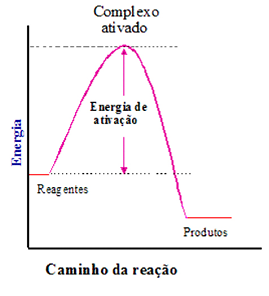
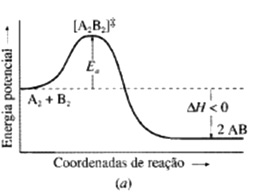
Energia de ativação é a diferença de energia entre o complexo ativado e os reagentes.
.
.
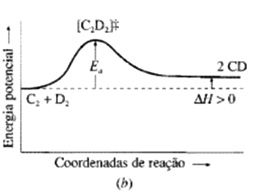
Variação de energia no decorrer de uma reação. (a) Reação exotérmica e (b) Reação endotérmica.
Teoria do estado de transição
A2(g) + B2(g) 2AB(g)
O estado de transição é [A2B2]≠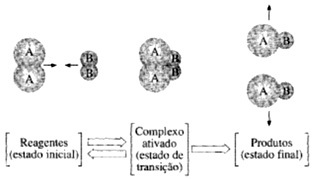
Confira agora a Lei da Velocidade nas Reações Químicas:
Acompanhe com o professor Felipe Sobis.
Exercícios para você resolver:
Questão 1 – O ácido sulfuroso (H2SO3) reage com o oxigênio na atmosfera produzindo ácido sulfúrico
H2SO3(g) + ½O2(g) → H2SO4(g)
A velocidade dessa reação é aumentada 100 vezes na presença do catalisador Fe+3, presente na matéria particulada da atmosfera. Analise o gráfico que representa a reação citada:
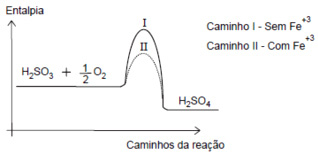
Sobre os caminhos I e II, são feitas as seguintes afirmações:
I. Têm os mesmos complexos ativados.
II. Possuem diferentes energias de ativação.
III. Têm diferentes entalpias de reação.
Está(ão) correta(s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas i e III.
Dica 1 – Revise com a gente sobre as Propriedades coligativas das soluções nesta aula de Química Enem. O Exame Nacional do Ensino Médio está chegando! – https://blogdoenem.com.br/propriedades-coligativas-das-solucoes-quimica-enem/
Questão 2 – O sulfato de manganês (MnSO4 ) é formado na solução do solo, quando o ânion sulfato (SO4-2) reage com o cátion Mn+2, segundo a reação
Mn+2(aq) + SO4-2(aq) MnSO4(aq)
A lei de velocidade dessa reação é
v = k[Mn+2] [SO4-2]
Se as concentrações molares dos íons Mn+2 e SO4-2 forem simultaneamente duplicadas, permanecendo as demais condições constantes, nota-se que a velocidade da reação:
a) diminui pela metade.
b) permanece constante.
c) duplica.
d) fica três vezes maior.
e) fica quatro vezes maior.
Dica 2 – Você sabe tudo sobre Concentração das Soluções? Revise com mais esta aula preparatória para a prova de Química Enem! – https://blogdoenem.com.br/concentracao-das-solucoes-quimica-enem/
Questão 3 – A água é vital aos seres humanos, sendo assim um fator determinante para a existência de vida no planeta. Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de 4 mols de oxigênio por minuto. Consequentemente, a velocidade de consumo de hidrogênio é de:
a) 8 mols/minuto
b) 4 mols/minuto
c) 12 mols/minuto
d) 2 mols/minuto
e) 16 mols/minuto
Dica 3 – Relembre aqui tudo sobre Dispersões em mais esta aula preparatória para a prova de Química Enem. Estude com a gente para o Exame Nacional do Ensino Médio.
Questão 4 – Apesar da formação de água a partir da reação do gás hidrogênio (H2) com o gás oxigênio (O2) ser termodinamicamente favorável, é necessário que altas energias (ex.: provenientes de descargas elétricas (raios)) sejam fornecidas para que a reação ocorra. Isso se deve, pois o complexo ativado da reação:
a) possui mais energia que os reagentes ou os produtos.
b) age como catalisador.
c) sempre forma produtos.
d) é composto estável.
e) possui menos energia que os reagentes ou os produtos.
Questão 5
Quando a água oxigenada (H2O2) fica muito tempo exposta à radiação ultravioleta (UV), a mesma é degradada à água (H2O) e gás oxigênio (O2). Nessa reação, a velocidade média, num certo intervalo de tempo, é de 8 mols/s em relação à água oxigenada. Qual é a velocidade em relação ao oxigênio nesse mesmo intervalo de tempo?
a) 8 mols/s
b) 16 mols/s
c) 4 mols/s
d) 2 mols/s
e) 10 mols/s
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!