Revise tudo sobre o Cálculo de DeltaH, Entalpia e Entropia em mais uma aula de Química Enem
Aprenda mais sobre entalpia e o Cálculo de ΔH nesta aula gratuita de Química para o Enem e o Vestibular. Esse conteúdo é muito recorrente nas provas.
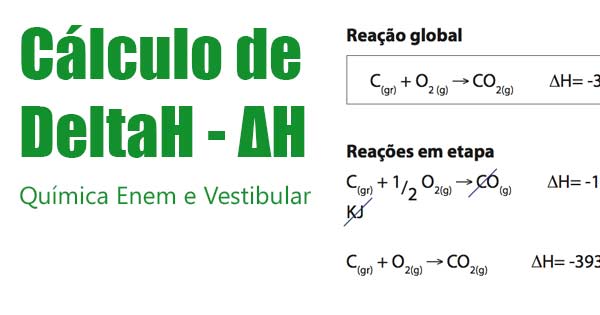
Lei de Hess: “A variação de entalpia para qualquer processo depende somente da natureza dos reagentes e produtos, e independe do número de etapas do processo ou da maneira como a reação ocorre.”

Entalpias de formação padrão (ΔHof):
ΔHof: entalpia padrão da reação de formação de uma substância a partir de seus elementos em suas formas mais estáveis. Ex.: Entalpia de formação do etanol:
2C(gr) + 3H2(g) + ½O2(g) → C2H5OH(l) ΔHof= -277.69kJ
OBS.: O coeficiente estequiométrico da substância que está sendo formada é sempre 1.
ΔHoreação = ΣΔHof produtos ΔHof reagente
ΔHof de uma substância pura é igual a zero.
Dica 1 – Revise tudo sobre os Principais compostos orgânicos e inorgânicos em mais esta aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/principais-compostos-organicos-e-inorganicos-quimica-enem/
Entropia
É a medida do grau de desordem de um sistema.
Quanto maior a desordem, maior a entropia (S).
“Ordem”: Proporção na qual as partículas estão restritas a certo espaço.

ΔS=S produtos – S reagentes
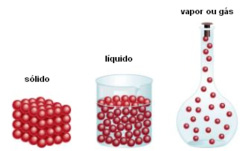
H2O(s) H2O(l) ΔS > O
H2O(l) H2O(g) ΔS > O
Entropia padrão molar S0
Cada substância tem um valor de S0 (entropia de um mol da substância pura a 1atm e 25ºC).
Unidade: J.K-1.mol-1
OBS.:
S0 de substâncias são sempre positivas
os elementos têm S0 ≠ 0
S0 sólidos < S0 líquidos < S0 gases
Para reações
ΔS0 = Σ S0 produtos – Σ S0 reagentes
Está valendo pra você? Revise seus conhecimentos com a aula de introdução a entalpia com o Curso Enem Gratuito!
Dica 2 – Revise sobre a classificação e a nomenclatura dos Óxidos em mais esta aula preparatória para a prova de Química Enem – https://blogdoenem.com.br/oxidos-quimica-enem
Energia livre de Gibbs (G)
Relaciona ΔH e ΔS e permite prever a espontaneidade de um processo.
ΔG =ΔH –
T= temperatura absoluta (Kelvin)
Se ΔG < 0 o processo é espontâneo (exergônico)
Se ΔG > 0 o processo é não espontâneo (endergônico)
Se ΔG = 0 o sistema está em equilíbrio
A espontaneidade de uma reação é uma combinação de três fatores:
- variação de entalpia da reação (ΔH): relacionado à quebra e formação de ligações;
- variação de entropia da reação (ΔS): relacionado à variação no grau de desordem;
- Temperatura (T).
Variação de energia livre padrão (ΔG0)
ΔG0 = ΔH0 –
Considerando ΔH e ΔS praticamente constante com a temperatura, é possível calcular se um determinado processo ou reação será espontânea em diversas temperaturas.
Efeito da temperatura sobre ΔG
|
H sistema |
S sistema |
Espontânea |
|
-, exotérmica |
+, menos ordem |
Sim |
|
-, exotérmica |
-, mais ordem |
Depende de T e dos valores relativos de H e S do sistema, mas em geral os produtos são favorecidos nas temperaturas mais baixas |
|
+, endotérmica |
+, menos ordem |
Depende de T e dos valores relativos de H e S do sistema, mas em geral os produtos são favorecidos nas temperaturas mais elevadas |
|
+, endotérmica |
-, mais ordem |
Não |
Saiba mais sobre a entalpia de formação com nosso Curso Enem Gratuito. Depois de assistir, responda nossos desafios para ficar fera nas provas.
Desafios
Questão 1
Observe as reações.
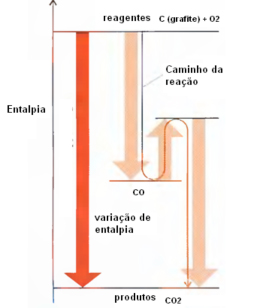
I) C grafite + O2(g) → CO2(g) ΔH= -394 kJ
II) C diamante + O2(g) → CO2(g) ΔH= -396 kJ
A variação da entalpia na reação de transformações do grafite em diamante é ____________, e essa é uma reação __________________.
a) -790 kJ – exotérmica;
b) -2 kJ – exotérmica;
c) 0 kJ – exotérmica;
d) +2 kJ – endotérmica;
e) +790 kJ – endotérmica.
Dica 3 – O Exame Nacional do Ensino Médio está chegando! Revise tudo sobre Bases: Definição de Arrhenius em mais esta aula de Química Enem – https://blogdoenem.com.br/bases-definicao-de-arrhenius-quimica-enem/
Questão 2
(UFSM)
A água
A água é uma das mais importantes substâncias do planeta Terra, tanto para os processos vitais como para os físico-químicos. No estado líquido e sólido, cobre mais de dois terços do pleneta e, na forma gasosa, é constituinte da atmosfera. Os organismos vivos originaram-se em meio aquoso e se tornaram dependentes dele no decurso da evolução. A água é o solvente universal, pois possibilita a maioria das reações químicas. Assim, o conhecimento de suas propriedades físico-químicas é essencial para o estudo de suas funções na natureza.
REICHARDT, K, TIMM, L. C. Solo, Planta e Atmosfera: conceitos, processos e aplicações. São Paulo: Ed. Manole, 2004. (adaptado)
Considere a reação:
2H2(g) + O2(g) 2H2O(g)
Dadas as equações termoquímicas
4H(g) → 2H2(g) ΔH= -871 kJ
2O(g) → O2(g) ΔH= -498kJ
4H(g) + 2O(g) → 2H2O ΔH= – 1849kJ
a entalpia de formação da água pode ser obtida pela lei de Hess e é igual a:
a) + 3.218kJ
b) + 480 kJ
c) + 322 kJ
d) – 480 kJ
e) – 3.218 kJ
Questão 3
(UFSM)
A decomposição da matéria orgânica no solo de pântanos pode gerar gás metano. Ao sair do solo, o metano se mistura com o oxigênio do ar e se inflama espontaneamente, gerando uma chama azulada.
A combustão do metano pode ser representada pela seguinte reação:
CH4(g) + 2O2(g → CO2(g) + 2H2O(g)
Com base na tabela, a variação de entalpia (ΔH) da reação, em kJ.mol-1, é:
|
Ligação |
Energia de ligação (KJ. mol-1) |
|
C – H C = O O = O O – H |
413 744 498 462 |
a) + 5.984
b) + 688
c) – 256
d) – 688
e) – 5.984
Questão 4
(UFSM)
Na atmosfera, as moléculas de NO(g) têm um tempo de vida curto, pois reagem rapidamente com o O2(g) produzindo dióxido de nitrogênio (NO2(g)), segundo a reação:
NO(g) + 1/2 O2(g)  NO2(g)
NO2(g)
|
Substância |
Hºf, 25ºC (kJ mol-1) |
|
NO(g) O2 (g) NO2(g) |
90,25 0,00 33,20 |
A reação acima é ____________, e a variação de entalpia padrão (ΔH0) da reação, em kJ/mol, é ___________.
a) exotérmica ; -114,10
b) exotérmica ; -57,05
c) exotérmica ; -5,70
d) endotérmica ; + 57,05
e) endotérmica ; + 114,10
Questão 5
(UFSM)
As entalpias-padrão de formação de alguns compostos são mostradas na tabela:
|
Composto |
Entalpia-padrão de formação (kJ.mol-1), 25ºC, 1atm |
|
CH4(g) |
-74 |
| C2H6O(l) | -278 |
| H2O(l) | -268 |
| CO2(g) | -394 |
Os combustíveis são queimados de acordo com a equação:
Combustível + xO2(g) → yCO2(g) + zH2O(l)
A 25 ºC e 1 atm, os calores de reação de um mol dos combustíveis metano e etanol, em kJ/mol, são respectivamente:
a) -74 e -278.
b) 74 e 278.
c) -892 e -1368.
d) -966 e -1646.
e) 892 e 1368.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!