Eletrólise em solução aquosa é aquela que ocorre quando os íons estão livres na água, devido aos fenômenos de dissociação iônica ou ionização. É simples para você dominar o tema. Veja nos resumos com as professoras Larissa Campos e Felipe Sobis.
Revisão gratuita sobre Eletrólise. É hora de você recuperar este conteúdo e não esquecer mais. Parece complicado, mas é bem simples de entender. Vamos lá. Para começar pense no funcionamento de uma pilha. Pensou aí? Então, agora é hora de inverter tudo, que aí você fica mais próximo do que é e como funciona uma reação química de Eletrólise.
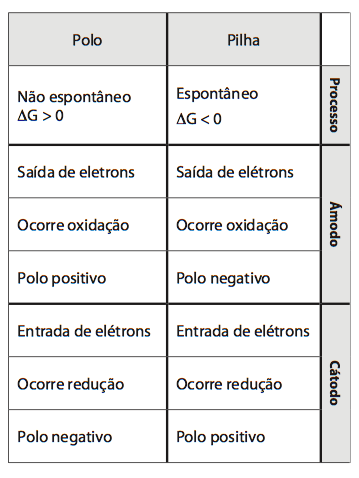
O fenômeno de Eletrólise é basicamente o contrário do que acontece com uma pilha. Enquanto o processo da pilha é espontâneo após a conexão entre os polos (∆E0 > 0), o fenômeno da Eletrólise é não espontâneo (∆E0 <0).
Se ainda não está claro prar você, não se preocupe. Veja agora um resumo com uma introdução bem didática da professora Larissa Campos, do canal do Curso Enem Gratuito.
Introdução à Eletrólise
Entenda o que é a Eletrólise:
- A eletrólise é um processo eletroquímico forçado, não espontâneo, que visa obter compostos importantes que não existem na natureza.
- Neste processo de eletrólise, é necessário fornecer eletricidade para que as reações de oxirredução possam ocorrer, pois elas não ocorrem naturalmente.
- A eletrólise ocorre em substâncias iônicas, que se mantêm por meio de ligações iônicas realizadas entre metais com ametais.
- Nesta aula acima, a professora Larissa te ensina os conceitos gerais do que é e como funciona a eletrólise.
Para a Eletrólise acontecer o fenômeno precisa ser induzido. Ou seja, a Eletrólise é provocada pela corrente elétrica aplicada à solução. Veja o esquema a seguir para entender a Eletrólise: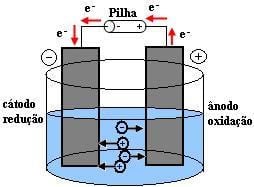 Veja como é diferente do que acontece numa Pilha. Resumindo na imagem para você o que acontece na Eletrólise e o que acontece na Pilha:
Veja como é diferente do que acontece numa Pilha. Resumindo na imagem para você o que acontece na Eletrólise e o que acontece na Pilha:
A realização da eletrólise exige íons com livre movimentação para que os cátions dirijam-se para o cátodo e os ânions, para o ânodo. Essa movimentação pode ser conseguida de duas formas.
- fusão do composto iônico (Eletrólise ígnea)
- dissolução do composto (Eletrólise em solução aquosa)
Eletrólise Ígnea
Eletrólise realizada em altas temperaturas para que haja a fusão da substância que se pretende submeter a esse processo.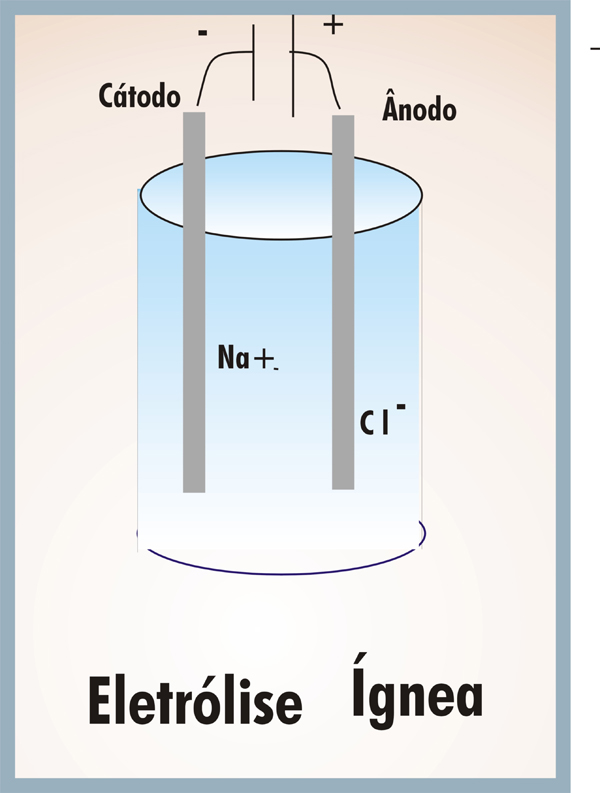
Exemplo: eletrólise ígnea do NaCl:
1º → dissociação iônica: 2NaCl(l) → 2Na+ + 2Cl–
2º → semirreação catódica: 2Na+ + 2e– → 2Na(l)
3º → semirreação anódica: 2Cl– → 2e– + Cl2(g)
Reação global:
2NaCl(l) → 2Na(l) + Cl2(g)
Método industrial para obtenção do sódio metálico e gás cloro.
Eletrólise Aquosa
Eletrólise em solução aquosa é aquela que ocorre quando os íons estão livres na água, devido aos fenômenos de dissociação iônica ou ionização. Não podemos esquecer que agora temos também na solução os íons H+ e OH- provenientes da água.
Confira no resumo com o professor Felipe Sobis, do Curso Enem Gratuito, o processo da Eletrólise em Solução Aquosa:
Veja um exemplo de Eletrólise Aquosa:
Confira a eletrólise em solução aquosa do NaCl. NaCl + H2O → Na+ + Cl– + H+ + OH–
No polo negativo, redução: 2H+ + 2e– → H2(g)
No polo positivo, oxidação: 2Cl– → Cl2(g) + 2e–
Macetes de Eletrólise:
Como saber quem vai reagir no cátodo e no ânodo? A ordem de facilidade é a seguinte:
Fila para descarga no cátodo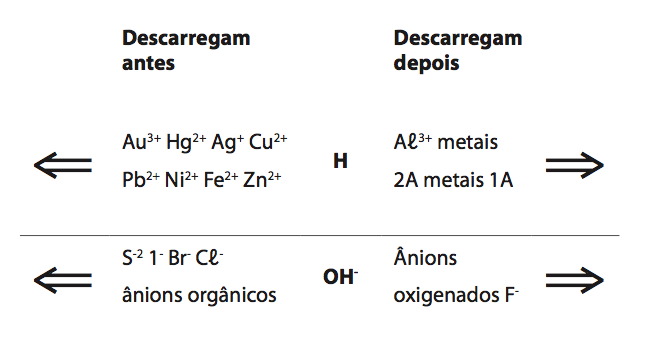
Aplicações para a eletrólise: Eletrodeposição ou Galvanização
Consiste em revestir um objeto metálico com um outro metal. Há uma série de aplicações para a galvanoplastia, como a prateação e a douração para melhorar o aspecto do objeto.
A deposição de estanho sobre o aço produz a folha-de-flandres, conhecida como lata.
A obtenção de metais, como o alumínio, sódio, níquel, ocorre a partir de seus respectivos minerais.
A produção de peças cromadas trabalha com a deposição de cromo sobre a peça desejada, partindo de um sal que contenha o elemento cromo.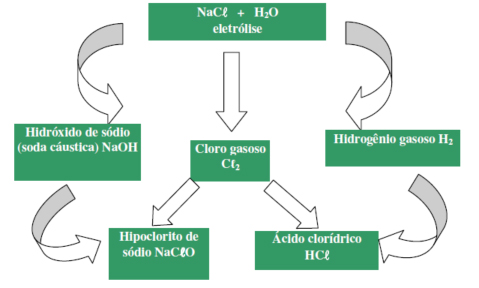
Quer mandar bem nas questões de Física do Enem? Veja as aulas gratuitas do Curso Enem Online, do Blog do Enem. Você encontra Física e todas as matérias que caem no Exame, e também as dicas de Redação. Acesse aqui o Curso Enem Gratuito
Desafios de Eletrólise para você resolver e compartilhar
Questão 1
Um dos métodos de obtenção de sódio metálico é a eletrólise ígnea de cloreto de sódio. Nesse processo, com a fusão do sal, os íons:
a) Cl– cedem elétrons aos íons Na+, neutralizando as cargas elétricas.
b) Cl ganham prótons e se liberam como gás cloro.
c) Cl– são atraídos para o catodo e nele ganham elétrons.
d) Na+ são atraídos para o ânodo e nele perdem prótons.
e) Na+ ganham elétrons e se transformam em Na°.
Dica 1 – O Exame Nacional do Ensino Médio está chegando, mas você está 100% preparado? Revise com a gente sobre Eletroquímica nesta aula de Química Enem – https://blogdoenem.com.br/eletroquimica-quimica-enem/
Questão 2
Industrialmente, a soda cáustica (NaOH) é obtida por eletrólise de uma solução aquosa de cloreto de sódio. Durante essa eletrólise, obtêm-se como subprodutos:
a) hidrogênio e cloro no ânodo
b) somente hidrogênio no ânodo
c) somente cloro no catodo
d) hidrogênio e cloro no catodo
e) somente cloro no anodo
Dica 2 – Preparado para a prova do Exame Nacional do Ensino Médio? Estude sobre o Número de Oxidação nesta aula de Química Enem que elaboramos para você. – https://blogdoenem.com.br/numero-de-oxidacao-quimica-enem/
Questão 3
O gás cloro pode ser obtido pela eletrólise da água do mar ou pela eletrólise ígnea do cloreto de sódio. Assinale a afirmativa correta com relação a esses dois processos:
a) ambos liberam Cl2 gasoso no catodo
b) ambos envolvem transferência de 2 elétrons por mol de sódio
c) ambos liberam H2 no catodo
d) ambos liberam Na metálico no catodo
e) um libera H2 e outro Na metálico no catodo
Dica 3 – A Cinética Química é o estudo que determina as velocidades das reações químicas. Revise tudo sobre Cinética Química em mais uma aula de Química Enem – https://blogdoenem.com.br/cinetica-quimica-quimica-enem/
Questão 4
A figura a seguir mostra o esquema da aparelhagem utilizada por um aluno para realizar a eletrólise de uma solução aquosa ácida, com eletrodos inertes. Du- rante a realização da eletrólise, pela secção tracejada (A—-B), houve a seguinte movimentação de partículas eletricamente carregadas através da solução:
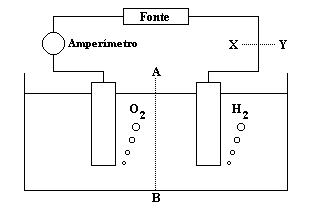
a) Elétrons da esquerda para a direita.
b) Elétrons da direita para a esquerda.
c) Cátions da esquerda para a direita e ânions da direita para a esquerda.
d) Cátions da direita para a esquerda e ânions da esquerda para a direita.
e) Cátions e ânions da esquerda para a direita.
Questão 5
Três erres
A produção industrial e a própria sobrevivência humana na Terra estão baseadas no desenvolvimento da forma academicamente conhecida como os três erres: Redução, Reaproveitamento e Reciclagem.
Redução é a introdução de novas tecnologias na exploração, no transporte e no armazenamento das matérias-primas para reduzir ou, se possível, eliminar o desperdício dos recursos retirados do planeta.
Reaproveitamento é a reintrodução, no processo produtivo, de produtos não mais aproveitáveis para o consumo, visando à sua recuperação e recolocação no mercado, evitando assim o seu encaminhamento para o lixo.
Reciclagem consiste na reintrodução dos resíduos solidos, líquidos ou gasosos já usados para que possam ser reelaborados, gerando um novo produto.
(Banas Ambiental, dezembro de 1999, p.32.)
A produção de alumínio consome uma quantidade enorme de energia elétrica – para produzir 1 kg de alumínio, consomem-se 15 vezes mais energia do que para 1 kg de aço.
A solução está na reciclagem do alumínio. O alumínio é refundido e reaproveitado, com uma economia de cerca de 90% de energia.
Dentre as proposições abaixo, assinale a FALSA:
a) Na eletrólise ígnea do Al2O3, obtemos alumínio no anodo e oxigênio no catodo.
b) O principal minério de alumínio é a bauxita.
c) O alumínio reage com o ácido sulfúrico, produzindo sulfato de alumínio e gás hidrogênio segundo a reação: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
d) Fios de alumínio são bons condutores de corrente elétrica, e papel alumínio é usado em embalagens e isolamento térmico.
e) Na prática, o alumínio é menos reativo que o pre- visto, e este fato se deve ao fenômeno denominado apassivação, isto é, formação de uma película que o isola do ataque de muitos agentes agressivos.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
Quer mandar bem no Enem? Então, além desta aula sobre Eletrólise, veja também esta revisão completa sobre As Três Leis de Newton.




