Veja como se forma a corrente elétrica nas pilhas. Na origem, com Alexandre Volta, e depois com John Daniell, uma revolução no campo da Eletroquímica. Revise com o Curso Enem Gratuito para mandar bem nas questões de Química do Exame.
Eletroquímica, você lembra o que é? E as Pilhas de Alexandre Volta, e de John Daniell? Veja um resumo online com aula gratuita para revisar e mandar bem nas questões de Química do Enem.
A Eletroquímica estuda a transformação de energia química em elétrica e vice-versa. Os principais fenômenos envolvidos são a produção de corrente elétrica através de uma reação química de (pilha), e a ocorrência de uma reação química pela passagem de corrente elétrica (eletrólise).
Ou seja, nas pilhas ocorre uma reação espontânea de tipo redox que resulta numa quantidade de eletricidade. Já a Eletrólise é um processo de reação induzida, onde se converte energia elétrica em energia química.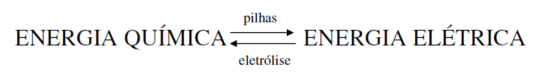
Veja o que são as pilhas
As pilhas são dispositivos que aproveitam a transferência de elétrons de uma reação de oxirredução, e que propiciam o aparecimento de uma corrente elétrica através de um condutor.
No caso das pilhas tradicionais, você não pode esquecer que os processos de Oxidação (perda de elétrons) e de Redução (ganho de elétrons) acontecem da seguinte maneira:
- Oxidação = perder elétrons = agente redutor = Zn0 → Zn2+ + 2e-
- Redução = ganhar elétrons = agente oxidante = Cu2 + 2e- → Cu0
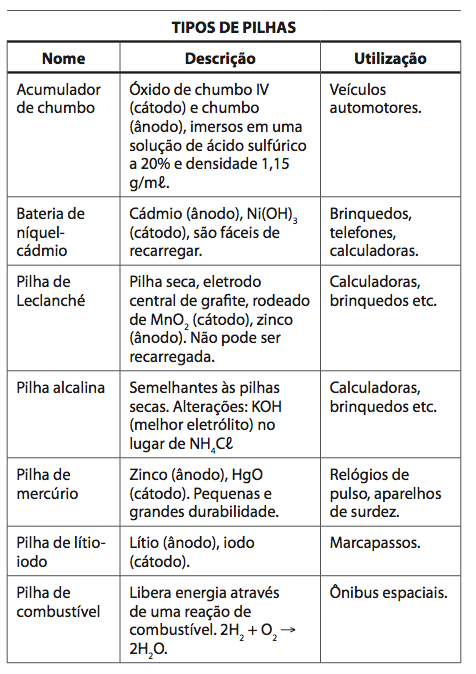
A história das pilhas
Você encontra dois marcos fundamentais na história das pilhas. Na origem, a pilha de Alexandre Volta, em 1800, em seguida, a Pilha de Daniell, em 1836. Alexandre Volta descobriu como transformar a energia química de reações de oxidação e de redução em energia elétrica.
O princípio da Pilha de Volta era a transferência de elétrons entre discos de prata e discos de zinco entremeados por camadas de papelão em solução de salmoura. Estes discos ‘empilhados’ e conectados nas extremidades por um fio condutor geravam uma ‘corrente de elétrons’. Vem dai o nome de Pilha.
Três décadas e meia depois o cientista inglês John Frederic Daniell (1790-1845) produziu uma evolução ao criar a Célula de Daniell, que era uma forma de Pilha estruturada com placas de cobre e de zinco mergulhadas em solução de Cu+2 e Zn+2.
Estas placas interligadas são chamadas de placas galvânicas, e que se conectadas externamente formando uma ‘ligação’, apresentavam a corrente elétrica que inaugurou uma nova etapa nas baterias.
Aula Gratuita sobre Eletroquímica – Entenda as Pilhas
Confira com o professor Felipe Sobis, do Canal Curso Enem Gratuito, uma revisão online completa sobre o funcionamento das Pilhas. Veja, e depois prossiga no post com a Pilha de John Daniell.
Veja a Pilha de John Daniell
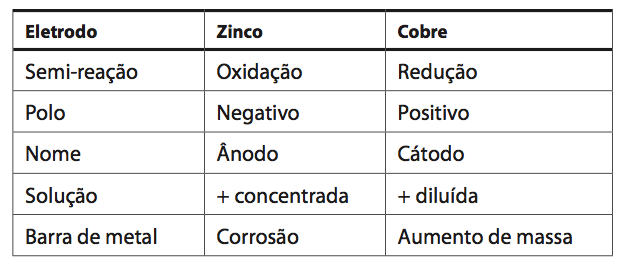
Observe na imagem abaixo uma Pilha de Daniell. Perceba que o sentido da movimentação dos elétrons é do eletrodo de zinco para o eletrodo de cobre. Com o passar do tempo, a lâmina de zinco vai sofrendo corrosão enquanto a massa da lâmina de cobre vai aumentando.
Consequentemente a solução do eletrodo de zinco fica cada vez mais concentrada, enquanto no eletrodo de cobre a solução fica mais diluída.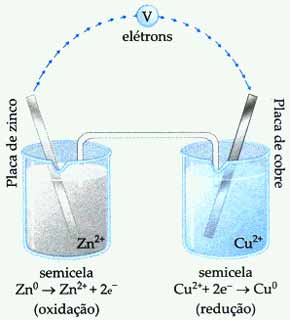
Resumindo o funcionamento ‘clássico’ de uma Pilha para você não esquecer:
A representação de uma pilha pode variar das seguintes formas:
(eletrodos)
Zno/Zn2+ → Cu2+/Cuo
(semirreações com potenciais de eletrodo)
Zno → Zn2+ + 2e– Ered: -0,76 V
Cu2+ + 2e– → Cuo Ered: +0,34 V
Zno + Cu2+ → Cuo + Zn2+
(reação global)
Potencial de Eletrodo
O sentido do deslocamento dos elétrons depende das substâncias utilizadas nos eletrodos. Estabelecendo a conexão entre as duas semicelas através de um fio condutor e colocando uma ponte salina, cada equilíbrio desloca-se no sentido do processo (oxidação ou redução) que possuir maior tendência a ocorrer.
Essa tendência a deslocar o equilíbrio eletrônico num dos sentidos foi denominada potencial de eletrodo, simbolizado por E. Portanto existe:
Potencial de Oxidação (Eoxid): indica tendência maior a deslocar o equilíbrio no sentido da oxidação.
Potencial de Redução (Ered): indica tendência maior a deslocar o equilíbrio no sentido da redução.
Obs.: Influenciado pela temperatura, pressão e concentração do eletrodo. Convenção: 1atm, 25o C, solução a 1mol/L, medida padrão (Volt).
Eletrodo de Hidrogênio
O eletrodo de hidrogênio é constituído por uma solução 1mol/L de ácido, pela qual passa um fluxo de gás hidrogênio, à pressão constante de 1atm e 25o C. Uma lâmina de platina estabelece o contato entre o eletrodo e o circuito externo e facilita a reação de oxidação-redução do hidrogênio, pois absorve o gás em sua superfície.
A esse eletrodo associou-se o valor de potencial nulo.
Então, para medir o potencial de um eletrodo, basta ligá-lo ao eletrodo padrão em uma montagem semelhante à pilha de Daniell. O voltímetro acusa uma ddp (diferença de potencial). Na imagem um Voltímetro.

Exemplos: – No caso do metal zinco, o voltímetro acusa uma ddp de 0,76V. Note que a barra de zinco sofre corrosão, então, conclui-se que o zinco está sofrendo oxidação, logo, seu potencial de oxidação será +0,76V e seu potencial de redução -0,76V.
Já no caso do metal cobre, ocorre um aumento da sua massa, o que é sinal de redução. Como o voltimetro acusa uma voltagem de 0,34V, conclui-se que seu potencial de redução é de +0,34V, e seu potencial de oxidação é de -0,34V.
Comparando esses dois metais, o cobre possui uma tendência maior a sofrer redução enquanto o zinco, de sofrer oxidação.
Com os valores dos potenciais de cada metal, é possível prever então que vai oxidar e reduzir, bem como a voltagem gerada pela pilha a ser montada pela equação:
∆E0 = Ered maior – Ered menor
Exemplo: Zno + Cu2+ → Cuo + Zn2+
∆E0 = +0,34 – (-0,76)
∆E0 = 1,10 V
Confira também a revisão de Eletroquímica do Curso Enem Gratuito e teste seus conhecimentos com o simulado específico sobre esse assunto!
Íons e Cátions
Veja agora comn o professor felipe Sobis como se comportam as reações onde acontecem gnahos ou perdas de elétrons e complete a sua revisão de Eletroquímica.
Íons e Cátions:
- O que são íons? Íons são partículas, derivadas de átomos ou de moléculas, que possuem carga elétrica. Íons negativos apresentam excesso de elétrons. Já íons positivos apresentam deficiência de elétrons.
- Os átomos, ao ganharem ou perderem elétrons, originam dois tipos de íons: Íons positivos = cátions; Íons negativos = ânions.
- Já os cátions, formam-se quando um átomo perde um ou mais elétrons, resultando num sistema eletricamente positivo, em que o número de prótons é maior que o número de elétrons.
- Em contrapartida, os ânions formam-se quando um átomo ganha ou recebe um ou mais elétrons, resultando num sistema eletricamente negativo, em que o número de prótons é menor que o número de elétrons.
- Confira na aula acima.

