Veja como acontecem e quais são as características das Ligações Metálicas. Confira também as Ligações Iônicas e as Ligações Covalentes.
A maior parte dos átomos que compõem o universo ao seu redor interagem entre si com o objetivo de se estabilizarem e, por conta disso, formam diferentes combinações que dão origem à uma enorme variedade de moléculas.
Dependendo de como estes átomos interagem entre si, iremos classificar as ligações químicas que eles formam em ligações iônicas, covalentes ou metálicas.
Neste post você vai revisar um desses tipos de ligação química: as ligações metálicas. Você sabe como elas ocorrem? Conhece suas características? Não? Não esquenta! O Blog do Enem te ajuda a gabaritar Química no Enem com esta aula da professora Munique Dias.
O que é uma Ligação Química?
Tire suas dúvidas iniciais com as dicas do professor de química Felipe Sobis, do canal do Curso Enem Gratuito. Ele vai mostrar para você as Ligações Químicas Iônicas e as Ligações Covalentes.
E as Ligações Metálicas?
– Você já deve ter sacado pelo nome que as ligações metálicas ocorrem entre metais, certo? Então, para começarmos a entender essas ligações, vamos revisar as principais propriedades dos metais:
- Condutibilidade elétrica: Os metais são excelentes condutores de corrente elétrica, tanto na fase sólida, como na fase líquida.
- Fase de agregação: todos os metais se apresentam na fase sólida em condições ambientes, com exceção do mercúrio, que é líquido nessas condições.
- Pontos de fusão e ebulição: A. maioria dos metais possui alto ponto de fusão e ebulição;
- Dureza: Em geral, os metais são sólidos moles (são facilmente riscados por outros materias), mas há algumas exceções como o irídio e o crômio, cuja dureza é elevada.
- Tenacidade: Possuem alta tenacidade, suportando pressões elevadas sem sofrer rupturas.
- Resistência à tração: Os metais são resistentes às forças aplicadas ao se “puxar” ou “alongar” uma barra ou um fio metálico.
- Maleabilidade: São facilmente transformados em lâminas;
- Ductibilidade: Possuem elevada ductibilidade, ou seja, aquecendo o metal e altas temperaturas, podemos facilmente transforma-los em fio.
- Solubilidade: Os metais são insolúveis em água, óleo ou qualquer solvente semelhante, embora possam reagir com certos solventes (como ácidos, bases ou até com água, como ocorre, por exemplo, com os metais alcalinos ou alcalino terrosos), sofrendo uma reação química.
Ligações metálicas
Como já conversamos acima, as ligações metálicas são tipos de ligações químicas que ocorrem entre metais, as quais formam uma estrutura cristalina chamadas de “ligas metálicas” (união de dois ou mais metais).
Resumo de Ligações Metálicas
Confira com a professora Larissa Campos, do canal do Curso Enem Gratuito, uma introdução completa sobre as Ligações Metálicas:
Na ligação entre átomos de um elemento metálico, ocorre a liberação parcial dos elétrons mais externos, com a consequente formação de cátions. Esses elétrons liberados são chamados de semi-livres porque possuem mobilidade na estrutura.
Em outras palavras, os elétrons mais externos, uma vez que estão mais distantes do núcleo do átomo, movimentam-se livremente formando uma “nuvem” ou um “mar” de elétrons.
Esse modelo confere a propriedade de maleabilidade e ductibilidade dos metais uma vez que esses elementos correspondem a um conglomerado de átomos neutros e cátions, imersos numa nuvem ou “mar” de elétrons livres, formando, assim, as ligações metálicas as quais mantém os átomos unidos por meio de um retículo cristalino.
Ligas metálicas
Raramente um metal puro apresenta todas as qualidades necessárias para determinada aplicação. Por exemplo, o ferro puro reage facilmente com o oxigênio e é quebradiço, o magnésio é inflamável e muito reativo, o ouro e a prata são muito moles, o crômio e o irídio são excessivamente duros.
Misturando-se um ou mais metais ou um metal com outra substância simples (não necessariamente metálica), é possível obter um material com propriedades que cada substância não tinha individualmente e que serão úteis para determinada aplicação. Então, podemos dizer que:
LIGA METÁLICA É UMA MISTURA DE SUBSTÂNCIAS CUJO COMPONENTE PRINCIPAL É UM METAL.
Para obter uma liga metálica, é necessário submeter às substâncias que formarão a liga a uma temperatura elevada até a fusão completa de todos os componentes para, em seguida, deixar a mistura esfriar e solidificar totalmente.
No instante da solidificação pode ocorrer uma das seguintes situações, conforme as características dos metais utilizados:
- Os metais possuem retículos cristalinos muito semelhantes em forma e tamanho: pode ocorrer a formação de um único retículo cristalino. Nesse caso consideramos a liga metálica homogênea (solução sólida). Exemplo disso são as ligas monetárias feitas de cobre e níquel.
- Os dois metais possuem retículos cristalinos muito diferentes em forma e tamanho: ocorre a formação de retículos cristalinos individuais de cada metal. Nesse caso, consideramos um mistura heterogênea (embora só seja possível perceber os diferentes cristais através de um microscópio). Exemplo disse é a obtenção do magnálio (liga de alumínio e magnésio).
- Formação de compostos intermetálicos: é o caso de ligas metálicas que apresentam uma composição química bem definida, como, por exemplo: CaPb3,AgZn,Cu2Sb,Cu5Zn8
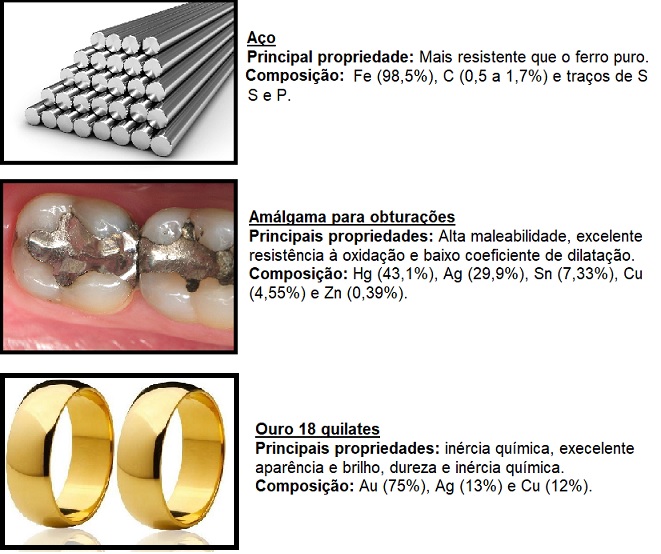
A figura abaixo mostra exemplos de algumas ligas metálicas de interesse industrial:
Dica 1 – Reveja também as Ligações iônicas. Acesse a aula da professora Munique Dias e veja um super-resumo sobre ligações químicas. Vai ficar de fora dessa?
Neste resumo você aprendeu:
- Ligações Químicas
- Ligações Metálicas
- Ligações Iônicas
- Ligações Covalentes
Para treinar um pouco sobre ligações metálicas, que tal testar seu conhecimento? Você consegue resolver este exercício?
(UFRS) O metal presente nas ligas de latão e bronze é:
a. ferro
b. estanho
c. zinco
d. cobre
e. alumínio
Resposta: d