O conceito de Gás Ideal é meramente teórico, pois gases deste tipo não existem na prática. Estude o Gás Ideal nesta aula de Física para o Enem!
O gás perfeito ou gás ideal é um modelo teórico que permite estudar o comportamento dos gases em geral de maneira simplificada. Observe que o gás ideal não existe na prática.

No modelo do gás ideal:
• as moléculas, imaginadas como esferinhas rígidas, estão em um constante estado de movimentação caótica e desordenada;
• as moléculas só interagem durante as colisões, contra as paredes do recipiente em que o gás está contido ou contra outras moléculas, e, entre as colisões, as moléculas descrevem um movimento retilíneo e uniforme;
• todos os choques são elásticos, isto é, ocorrem sem perda de energia cinética e têm duração desprezível;
• o volume total das moléculas é muito menor do que o volume do gás.
Observa-se que a altas temperaturas e a baixas pressões, os gases reais, principalmente os gases monoatômicos, comportam-se aproximadamente como gases ideais.
A lei de Avogadro e o número de Avogadro
Em 1811, o químico e físico italiano, Amedeo Avogadro (1776-1856), enunciou uma lei que passou a ser conhecida como a lei de Avogadro:
“Iguais volumes de quaisquer gases encerram o mesmo número de moléculas, quando medidos nas mesmas condições de temperatura e pressão”.
Uma confirmação da lei de Avogadro vem expressa na seguinte propriedade experimental:
1 mol de qualquer gás à temperatura de 0 °C e à pressão de 1 atm ocupa um volume de 22,4 litros.
A quantidade de matéria equivalente a 1 mol de um gás é o conjunto constituído por 6,02•1023 moléculas desse gás. Esse número, geralmente representado por N0, é denominado número de Avogadro. Assim: N0 = 6,02•1023.
Dica 1 – A troca de calor pode acontecer de três maneiras: por condução; convecção ou por irradiação. Revise sobre Transmissão de Calor nesta aula de Física Enem – https://blogdoenem.com.br/transmissao-de-calor-fisica-enem/
O número de mols, n, de um gás é dado pelo quociente da massa m do gás pela sua massa molar M ou pelo quociente do número de moléculas N do gás pelo número de Avogadro, N0:
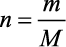 ou
ou 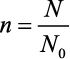
A equação de Clapeyron
O comportamento e o estado termodinâmico de um gás ideal podem ser descritos de forma simplificada a partir de três grandezas físicas, denominadas variáveis de estado. São elas:
• a pressão p (devida ao choque das moléculas contra as paredes do recipiente em que o gás está contido);
• o volume V (igual ao volume do recipiente em que o gás está contido);
• a temperatura absoluta T, sempre medida na escala Kelvin.
Dica 2 – Se você não sabe que a trajetória dos planetas é elíptica, então estude sobre as Leis de Gravitação e fique preparado para gabaritar na prova de Física Enem – https://blogdoenem.com.br/leis-de-gravitacao-de-kepler-fisica-enem/
O engenheiro e físico francês Benoit Paul Émile Clapeyron (1799-1864), ao analisar as leis experimentais de Boyle-Mariotte, Charles, Gay-Lussac e Avogadro sobre o comportamento de gases monoatômicos reais mantidos a altas temperaturas e a baixas pressões, concluiu que a relação
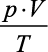
é diretamente proporcional ao número n de mols n do gás.
A constante de proporcionalidade, geralmente representada por R, não depende das condições, da massa ou do tipo de gás e assume o mesmo valor para todos os gases.
Temos, então, a equação que rege o comportamento dos gases ideais, conhecida como equação de Clapeyron:
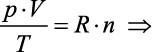
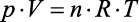
(equação de Clapeyron)
A constante R é denominada constante universal dos gases perfeitos e seu valor numérico dependerá sempre das unidades de medidas da pressão e do volume do gás:
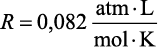 ou, no SI,
ou, no SI, 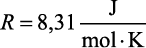
A lei geral dos gases perfeitos
Consideremos uma determinada quantidade de gás, inicialmente em um estado 1 (definido pela pressão p1, volume V1 e temperatura T1) e que, ao sofrer uma transformação, passa para o estado 2 (definido pela pressão p2, volume V2 e temperatura T2), conforme mostrado a seguir.
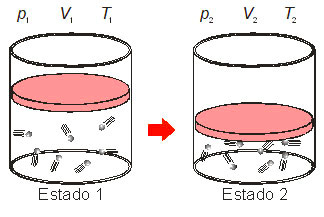
Da equação de Clapeyron, podemos escrever:
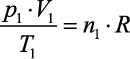 (para o estado 1)
(para o estado 1)
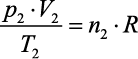 (para o estado 2)
(para o estado 2)
Dica 3 – Revise sobre Estática e Equilíbrio do ponto material em mais esta aula preparatória para a prova de Física Enem – https://blogdoenem.com.br/estatica-fisica-enem/
Como na transformação a quantidade de gás não variou (n1 = n2), podemos igualar o quociente dos dois estados e obter a lei geral dos gases perfeitos.
Ficamos, então, com:
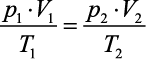 (Lei geral dos gases perfeitos)
(Lei geral dos gases perfeitos)
Transformações gasosas particulares
Conforme vimos anteriormente, Clapeyron obteve uma relação entre as variáveis de estado do gás (p, V e T) e a quantidade de gás (n) ao analisar as leis experimentais de Boyle-Mariotte, de Charles e de Gay-Lussac.
Essas são leis que correspondem a transformações particulares de um gás.
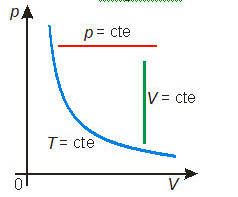
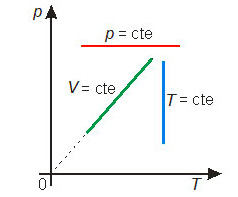
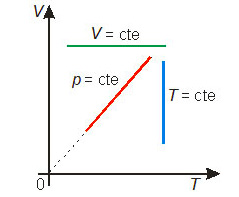
A lei de Boyle-Mariotte (transformação isotérmica)
Uma transformação na qual a temperatura permanece constante é chamada transformação isotérmica.
A lei de Boyle-Mariotte, enunciada em 1662 pelo cientista inglês Robert Boyle (1627-1691) e pelo cientista e padre francês Edme Mariotte (1620-1684), estabelece que:
“Sob temperatura constante, a pressão e o volume de uma dada massa de gás ideal são grandezas inversamente proporcionais.”
A lei de Charles (transformação isobárica)
Uma transformação na qual a pressão permanece constante é chamada transformação isobárica.
A lei de Charles, enunciada pelo físico francês Jacques Charles (1746- 1823) em 1787, estabelece que:
“Sob pressão constante, o volume e a temperatura de uma dada massa de gás ideal são grandezas diretamente proporcionais.”
A lei de Gay-Lussac (transformação isocórica)
Uma transformação na qual o volume permanece constante é chamada transformação isocórica (ou isométrica ou, ainda, isovolumétrica).
A lei de Gay-Lussac, enunciada pelo físico francês Joseph Gay-Lussac (1778-1850) em 1809, estabelece que:
“Sob volume constante, a pressão e a temperatura de uma dada massa de gás ideal são grandezas diretamente proporcionais.”
Observe que essas três leis podem ser obtidas a partir da lei geral dos gases perfeitos:
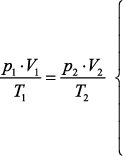
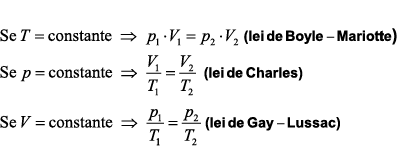
Essas transformações gasosas particulares podem ser representadas em diagramas cartesianos. Os diagramas mais comuns são: pressão × volume, denominado diagrama de Clapeyron, pressão × temperatura e volume × temperatura. A figura abaixo mostra cada uma das transformações particulares nos três diagramas mais comuns.

Saiba mais sobre Gás Ideal nesta aula do canal Fabrisfisica, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios
Questão 1
(UCMG) O volume ocupado por 2,0 mols de moléculas de um gás ideal à pressão de 2,0∙105 N/m2 e a 27 ºC é, em m3:
a) 4,4∙10–3
b) 2,2∙10–3
c) 2,5∙10–2
d) 2,2∙101
e) 2,5∙10–8
Dado: R = 8,31 J/(mol∙K).
Questão 2
(Unip–SP) Uma dada massa de um gás perfeito está a uma temperatura de 300 K, ocupando um volume V e exercendo uma pressão p.
Se o gás for aquecido e passar a ocupar um volume 2•V e exercer uma pressão 1,5•p, sua nova temperatura será:
a) 100 K
b) 300 K
c) 450 K
d) 600 K
e) 900 K
Questão 3
(PUC–PR) Observe o gráfico abaixo:
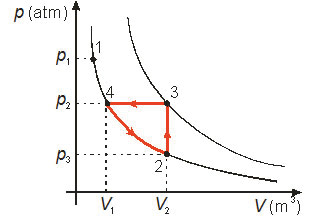
Nele, estão mostradas as transformações sofridas por um gás ideal quando se varia a temperatura, pressão ou volume.
A partir destas informações, pode-se afirmar que o gás evolui:
a) isobaricamente de 3 a 4.
b) isometricamente de 3 a 4.
c) isotermicamente de 2 a 3.
d) isometricamente de 4 a 2.
e) isobaricamente de 1 a 2.
Questão 4
(Fuvest–SP) Em algumas situações de resgate, bombeiros utilizam cilindros de ar comprimido para garantir condições normais de respiração em ambientes com gases tóxicos. Esses cilindros, cujas características estão indicadas na tabela, alimentam máscaras que se acoplam ao nariz.

Quando acionados, os cilindros fornecem para a respiração, a cada minuto, cerca de 40 litros de ar, à pressão atmosférica e temperatura ambiente. Nesse caso, a duração do ar de um desses cilindros seria de aproximadamente:
a) 20 minutos.
b) 30 minutos.
c) 45 minutos.
d) 60 minutos.
e) 90 minutos.
Questão 5
(Mack–SP) Uma massa de gás supostamente ideal, inicialmente a 47 °C, sofre uma variação de temperatura de 80 °C durante uma transformação isobárica. O volume dessa massa gasosa, após esse aquecimento, sofreu um aumento, em relação ao seu volume inicial, de:
a) 2,5 %
b) 4,0 %
c) 25 %
d) 40 %
e) 80 %
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
Curso Enem Gratuito
Quer aumentar suas chances no próximo Exame Nacional do Ensino Médio e mandar bem nas Notas de Corte do Enem? Estude com as apostilas e aulas gratuitas do Curso Enem Online. Todas as matérias do Exame e ainda as Dicas de Redação. Acesse aqui o Curso Enem Gratuito.

