Relembre tudo sobre a Primeira Lei da Termodinâmica em mais esta aula preparatória para as questões de Física na prova do Enem. Estude com a gente e fique preparado! Depois da aula, tem simulado.
A Primeira Lei da Termodinâmica é componente clássico no estudo da física para o Enem e o Vestibular. Ela trabalha o princípio da conservação da Energia. Veja abaixo revisão gratuita. Em seguida responda ao Simulado.
Em qualquer processo termodinâmico, a energia pode ser transferida de um sistema para outro sob duas formas: sob a forma de calor Q ou sob a forma de trabalho τ.
Ficou difícil ‘matar de primeira’? Então é porque você precisa mesmo revisar a 1ª Lei da Termodinâmica. Vem com a gente.
A Primeira Lei da Termodinâmica
Começando pelo começo: É importante relembrar que o calor Q é energia térmica transferida entre dois corpos ou entre dois sistemas devido a uma diferença de temperatura entre eles e que o trabalho τ é energia transferida entre sistemas pela ação de uma força.
Resumo da Primeira Lei da Termodinâmica
Confira com o professor Otávio Bocheco, o “Seco” do canal do Curso Enem Gratuito, as dicas para você dominar o princípio da conservação da Energia.
O Princípio da Conservação da Energia
Pelo princípio da conservação da energia, que estabelece que a energia não pode ser criada ou destruída, então a quantidade de calor Q transferida de um sistema para outro e o trabalho τ estão relacionados com a variação da energia interna ΔU do sistema.
A variação da energia interna ΔU de um sistema termodinâmico é, portanto, o resultado de um balanço energético entre o calor Q trocado e o trabalho τ envolvido na transformação.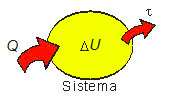 Dessa maneira, em uma transformação, a variação da energia interna ΔU do sistema depende do calor Q trocado e do trabalho τ na transformação.
Dessa maneira, em uma transformação, a variação da energia interna ΔU do sistema depende do calor Q trocado e do trabalho τ na transformação.
A primeira lei da termodinâmica estabelece que, em qualquer transformação: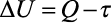
Variação de Energia e Troca de Calor
Essa lei de conservação de energia pode ser assim enunciada: A variação da energia interna ΔU do sistema é igual à diferença entre o calor Q trocado pelo sistema e o trabalho τ envolvido na transformação.
Sempre que aplicarmos a Primeira Lei da Termodinâmica, devemos seguir a convenção de sinais adotada para os sinais do calor trocado, do trabalho realizado e da variação da energia interna do sistema gasoso.
Veja um exemplo de “Máquinas Térmicas”
Confira agora com o professor Antônio Martins, o “Tonho” do canal do Curso Enem Gratuito, como acontece a produção de trabalho no motor de um carro. Assim você aprende uma aplicação da termodinâmica:
Veja agora a teoria por trás do “motor do carro”
• Calor trocado (Q)
- Q > 0: quando a quantidade de calor é recebida pelo sistema
- Q = 0: em uma transformação adiabática (o gás não recebe e nem perde calor)
- Q < 0: quando a quantidade de calor é perdida pelo sistema
• Trabalho realizado (τ)
- τ > 0: quando o trabalho é realizado pelo sistema sobre o meio exterior (expansão do gás)
- τ = 0: em uma transformação isocórica (o volume do gás não varia)
- τ < 0: quando o trabalho é realizado pelo meio externo sobre o sistema (contração do gás)
• Variação da energia interna (ΔU)
- ΔU > 0: quando a temperatura do gás aumenta (aquecimento)
- ΔU = 0: em uma transformação isotérmica (a temperatura não varia)
- ΔU < 0: quando a temperatura do gás diminui (resfriamento)
Aplicação numérica da 1ª Lei da Termodinâmica
Para melhor entender como aplicar a Primeira Lei da Termodinâmica às transformações gasosas, vamos resolver um exemplo numérico. (Questão da UFG) – Suponha que um sistema passe de um estado a outro trocando energia com a sua vizinhança. Dado: 1 cal = 4,18 J. Calcule a variação de energia interna do sistema nos seguintes casos:
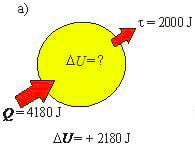
- a) o sistema absorve 1000 cal de calor e realiza um trabalho de 2000 J;
- b) o sistema absorve 1000 cal de calor e um trabalho de 2000 J é realizado sobre ele;
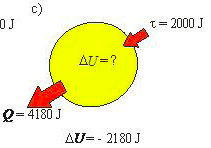
- c) o sistema libera 1000 cal para a vizinhança e um trabalho de 2000 J é realizado sobre ele.
Em todas as três situações, o calor trocado pelo gás (recebido ou perdido) é de 1000 cal, e como 1 cal = 4,18 J, esta quantidade de calor equivale a 4180 J.
- a) O gás absorve 1000 cal e, portanto, Q = + 4180 J
- O gás realiza um trabalho de 2000 J e, portanto, τ = + 2000 J
- Então: ΔU = Q – τ ⇒ ΔU = (+ 4180) – (+ 2000) ⇒ ΔU = + 2180 J (o gás esquenta).
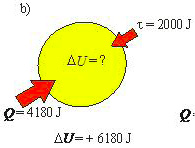
- b) O gás, mais uma vez, absorve 1000 cal e, portanto, Q = + 4180 J
- Um trabalho de 2000 J é realizado sobre o gás. Portanto, o gás recebe trabalho do meio externo e τ = – 2000 J
- Então: ΔU = Q – τ ⇒ ΔU = (+ 4180) – (– 2000) ⇒ ΔU = + 6180 J (o gás esquenta).
- c) O gás libera 1000 cal e, portanto, perde calor. Assim: Q = – 4180 J
- Mais uma vez, um trabalho de 2000 J é realizado sobre o gás. Portanto, o gás, mais uma vez, recebe trabalho do meio externo e τ = – 2000 J
- Então: ΔU = Q – τ ⇒ ΔU = (– 4180) – (– 2000) ⇒ ΔU = – 2180 J (o gás esfria)
- Em todas as situações sempre podemos usar um recurso gráfico para fazer o balanço energético e aplicar a Primeira Lei da Termodinâmica.

Resumo da 1ª Lei da Termodinâmica
Veja com o professor Rossetto, do Canal Curso Enem Gratuito, uma aula com foco no Enem e nos vestibulares, para você mandar bem nas questões de Termodinâmica. Veja a aula e continue estudando com a gente!
Muito bom este resumo sobre a primeira Lei da Termodinâmica! Vale a pena ver de novo.
Simulado Enem: a Lei da Termodinâmica
Teste o seu nível com 10 questões no Simulado de Física para o próximo Enem. Todas elas com foco em Termodinâmica. Responda e confira o seu desempenho na comparação com outros candidatos que responderam também. Clique na imagem:
Agora, mais exercícios para você resolver e compartilhar
Questão 1
(PUC – RJ) Em um processo termodinâmico Γ, uma quantidade de n mols de um gás ideal é aquecida por uma quantidade de calor Q = 1000 J e realiza trabalho igual a W. Ao fim do processo termodinâmico Γ, o sistema retorna à temperatura inicial, ou seja, à energia inicial. Calcule o trabalho realizado.
a) 1000•n J.
b) 0 J.
c) 2000 J.
d) 1000 J.
e) 500 J.
Resposta: A
Questão 2
(UECE) Pode-se afirmar corretamente que a energia interna de um sistema constituído por um gás ideal
a) diminui em uma expansão isotérmica.
b) aumenta em uma expansão adiabática.
c) diminui em uma expansão livre.
d) aumenta em uma expansão isobárica.
Resposta: D
Questão 4
(Unesp – SP) Um recipiente contendo um certo gás tem seu volume aumentado graças ao trabalho de 1664 J realizado pelo gás. Neste processo, não houve troca de calor entre o gás, as paredes e o meio exterior. Considerando que o gás seja ideal, a energia de 1 mol desse gás e a sua temperatura obedecem à relação
U = 20,8•T, onde a temperatura T é medida em kelvins e a energia U em joules. Pode-se afirmar que nessa transformação a variação de temperatura de um mol desse gás, em kelvins, foi de
a) 50.
b) – 60.
c) – 80.
d) 100.
e) 90.
Resposta: C
Questão 5
(UEL – PR) O calor específico molar de um gás é de 5 cal/(mol•K). Supondo que ele sofra variações termodinâmicas isovolumétricas e que sua temperatura aumente de 20 °C para 50 °C, com um número de mols igual a 4, qual será a variação da energia interna do sistema?
a) 30 cal.
b) 150 cal.
c) 600 cal.
d) 1800 cal.
e) 6000 cal.
Resposta: C