Existem algumas substâncias que indicam o pH das soluções. Essas são conhecidas como indicadores ácidos-base e são muito cobradas nas provas do Enem e dos vestibulares de todo Brasil, vamos estudá-las?
Os indicadores ácido-base são substâncias naturais ou sintéticas que têm a propriedade de mudarem de cor em função do pH do meio.
Dica 1– O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Esses indicadores apresentam uma cor quando estão em meio ácido e outra cor quando estão em meio básico.
O sistema de funcionamento dos indicadores é o seguinte: geralmente eles são um ácido fraco ou uma base fraca que entra em equilíbrio com a sua base ou ácido conjugado, respectivamente, que apresenta coloração diferente. Veja um exemplo:
Indicador ácido + H2O <—> H3O+ + Base conjugada
(cor A) (cor B)
Quando esse indicador genérico entra em contato com um meio ácido, segundo o Princípio de Le Chatelier, o equilíbrio é deslocado no sentido de formação do ácido fraco, ficando com a cor A. Por outro lado, se o indicador entrar em contato com um meio básico, os íons OH– da solução básica irão reagir com os íons H3O+ do indicador. Desse modo, o equilíbrio será deslocado no sentido de repor os íons H3O+, ou seja, para a direita, que é também o sentido de formação da base conjugada, e o sistema adquire a cor B.
Dica 2– Revise sobre os ácidos e bases acessando o nosso Blog do Enem e conferindo um super-resumo preparado pela professora Munique Dias. Não deixe essa chance passar!Aproveite. https://blogdoenem.com.br/enem-acidos-bases/
Quer saber mais sobre os indicadores ácido-base e suas aplicações? Então assista a videoaula do professor Mazzei e fique fera nesse assunto.
Existem vários indicadores artificiais usados em laboratório, vamos ver os mais utilizados:
Solução de fenolftaleína:
Esta solução é um indicador sintético que ao se dissolver em água se ioniza originando íons. Os íons liberados são H+ e OH– que estabelecem um equilíbrio em meio aquoso.
Quando se adiciona fenolftaleína em uma solução incolor, esta ao entrar em contato com uma base ou ácido muda de cor. Exemplo: se adicionarmos solução de fenolftaleína em um meio ácido ela fica incolor, pois o aumento da concentração de H+ desloca o equilíbrio. Por outro lado, se o meio for básico, a solução de fenolftaleína se torna rósea (rosa claro a rosa escuro).

Papel de tornassol
Papel de tornassol: Fica com cor azul na presença de bases e adquire cor vermelha na presença de ácidos.
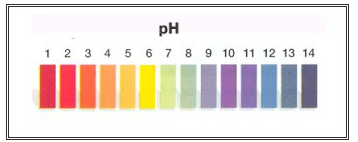
Escala de cores do papel tornassol de acordo com o pH da solução.
Indicador universal:
Eles são obtidos quando se imergem as tiras de papel em soluções com uma mistura de indicadores, que depois são secas. Desse modo, eles apresentam cores diferentes para cada valor de pH, sendo mais precisos do que os anteriores.
Dica 3 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares que é Soluções coloidais. Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-solucoes-coloidais/
Você sabia que existem também indicadores ácido-base naturais?
Um desses indicadores são as folhas do repolho roxo.

Em água (pH neutro = 7), ele tem coloração roxa, mas conforme a imagem abaixo mostra, ele muda de vermelho em solução ácida para púrpura e depois verde, quando em solução básica. No caso da solução ser fortemente ácida, ele torna-se amarelo:

Gostou do assunto? Então assista aqui a um vídeo que o Blog do Enem separou especialmente para você. Aqui o professor de química Marcelo Polachini realiza uma experiência para explicar os indicadores ácidos bases. Não deixe essa oportunidade passar.
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.




