Você já notou que ao chegarmos à praia a areia esquenta muito rápido, enquanto a água do mar demora o dia inteiro para esquentar? Isso se deve ao Calor Específico dessas substâncias. Viva a química!
Olá, vamos rever uma parte da química que causa muita dúvida nas provas de Vestibular e do Enem O calor específico é um assunto que confunde muitos alunos na hora das provas. Mas não se preocupe! Com as vídeo-aulas da Khan Academy e as explicações da professora Munique Dias você irá acertar todas as questões nas provas dos vestibulares.
Que tal antes de relembrarmos sobre calor específico, você recordar algumas definições de química? Vamos lá!
Calorimetria: É a parte da termologia que estuda os fenômenos relacionados ao calor.
Calor: É a energia em trânsito que flui espontaneamente de corpos de maior temperatura para corpos de temperatura menor.
Capacidade calorífica (C ) de uma substância é a quantidade de calor necessária para elevar de uma grau Celsius a temperatura de dada quantidade de substância.
O calor é medido em calorias (cal).
1 cal ≅ 4,18 J
1 kcal = 1.000 cal
Lembrou? Vamos ver agora a definição para calor específico (c)?
Consiste na quantidade de calor que é necessário fornecer à unidade de massa de uma substância para elevar a sua temperatura de um grau e uma unidade usual bastante utilizada para calores específicos calorias por grau Celsius por grama cal/(g.ºC).
Lembre-se: Quando a capacidade calorífica é dada para um mol de substância, esta passa a designar-se capacidade calorífica molar ou calor específico molar.
Quer saber mais? Assista a vídeo-aula totalmente gratuita do professor Ernani Ferrara e mande super bem nas provas do Enem e dos vestibulares.
Mas como é possível medir a transferência de calor?
Podemos medir a transferência de calor através de um calorímetro, que consiste em um dispositivo no qual transferências de energia como o calor são monitoradas observando-se mudanças na temperatura.
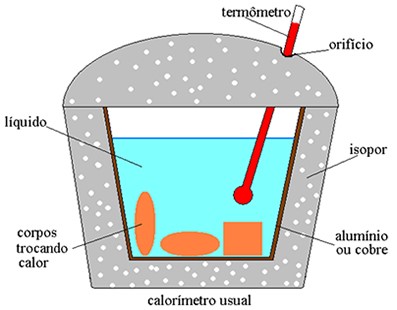
Que tal compararmos os valores de calor específico de alguns materiais? Veja a tabela abaixo:
|
Substância |
Calor Específico (cal/g.°C) |
|
1,0 |
|
|
0,58 |
|
|
0,22 |
|
|
0,24 |
|
|
0,12 |
|
|
0,031 |
|
|
0,094 |
|
|
0,11 |
|
|
0,5 |
|
|
1,25 |
|
|
3,4 |
|
|
0,092 |
|
|
0,42 |
|
|
0,033 |
|
|
0,25 |
|
|
0,032 |
|
|
0,22 |
|
|
0,056 |
|
|
0,21 |
|
|
0,16 |
|
|
0,093 |
Vamos entender a tabela?
Quanto maior o valor do calor específico de um corpo mais “difícil” é elevar sua temperatura. Observe a tabela, o material que precisa de maior energia para aquecer é o hidrogênio com 3,4 calorias para aumentar em um grau Celsius um grama de hidrogênio. Entendeu? E o que se aquecerá com mais facilidade é o chumbo que consumirá 0,031 calorias para aquecer em um grau Celsius um grama dessa substância.
Que tal ver mais exemplos? Assista ao vídeo da Khan Academy, traduzido para o português pela Fundação Lemann, e entenda mais sobre calor específico. Não perca tempo!
Dica 1– Se você não lembra o que é capacidade intensiva e extensiva das substâncias, acesse o link:
https://brasilescola.uol.com.br/quimica/propriedades-intensivas-extensivas.htm
A relação que existe entre capacidade calorífica e calor específico de uma substância é:
C = m.c
Onde:
C=capacidade calorífica
m = massa da substância
c = calor específico
Dica 2 – Veja os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann:
http://www.fundacaolemann.org.br/khanportugues/#videos
Se conhecermos o calor e a massa da substância, a variação da temperatura da amostra (Δt) nos indicará a quantidade de calor (q) que foi absorvida ou liberada em determinado processo, através da equação:
q = m.c. Δt
Onde:
m é a massa da amostra e Δt é a variação da temperatura.
Dica 3-Quer saber mais sobre calorimetria? Assista a esta vídeo-aula totalmente gratuita com teoria e exercícios para você saber tudo do assunto.
Gostou da revisão que o blog do Enem preparou pra você? Que tal um desafio? Pratique!
Em uma manhã de céu azul, um banhista na praia observa que a areia está muito quente e a água do mar está muito fria. À noite, esse mesmo banhista observa que a areia da praia está fira e a água do mar está morna. O fenômeno observado deve-se ao fato de que:
a) a densidade da água do mar é menor que a da areia.
b) o calor específico da areia é menor que o calor específico da água.
c) o coeficiente de dilatação térmica da água é maior que o coeficiente de dilatação térmica da areia.
d) o calor contido na areia, à noite, propaga-se para a água do mar.
e) a agitação da água do mar retarda seu resfriamento.
Resposta: B
Dica 4 – O que mais cai em Química nas provas do Enem e dos vestibulares? Veja aqui as melhores dicas para você mandar bem em Química: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
