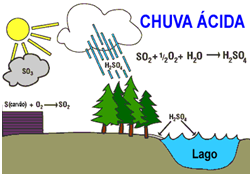
A chuva ácida, consequência da poluição do ar, é aquela com a presença dos ácidos sulfúrico, nítrico e nitroso, resultantes de reações químicas que ocorrem na atmosfera.
As atividades humanas podem influenciar fortemente os ecossistemas. Infelizmente, em geral, nossas atividades produzem resíduos que contaminam o ambiente e desequilibram as relações ecológicas. Entre as poluições mais graves emitidas pelos seres humanos estão as substâncias que contaminam o ar e acabam provocando consequências como a chuva ácida e a inversão térmica.
Riscos da poluição do ar para a saúde
A poluição do ar pode ser causada por várias substâncias produzidas de diferentes formas. A mais comum é causada pelo aumento de gás carbônico, que acentua o efeito estufa e gera o aquecimento global. Uma das principais fontes poluidoras do mundo moderno é o motor dos automóveis.
Quando a combustão de combustíveis fósseis nestes motores é completa, libera CO2. No entanto, quando a combustão é incompleta, há a liberação de um gás ainda mais tóxico, o monóxido de carbono (CO), composto que possui alta afinidade com as hemácias.
Ao associar-se à hemoglobina, forma-se um composto estável, a carboxiemoglobina. Assim, a hemoglobina ocupada pelo CO não pode transportar oxigênio, causando uma asfixia que pode levar a morte em seres humanos e outros seres aeróbios.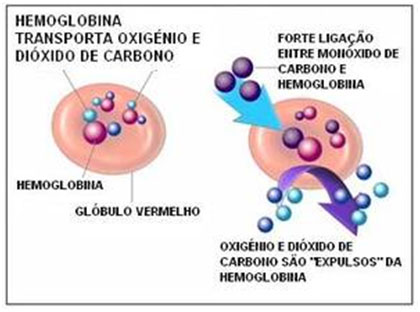
Além dos motores a combustão, as indústrias siderúrgicas e as queimadas são também importantes fontes de poluentes atmosféricos. Além do monóxido de carbono, as combustões incompletas também liberam hidrocarbonetos gasosos e óxidos de nitrogênio.
Ao serem expostos à radiação ultravioleta, esses dois compostos combinam-se produzindo substâncias ainda mais tóxicas: o ozônio e o nitrato peroxiacetílico (PAN). Essas substâncias causam irritação nos olhos e desconforto respiratório nos seres humanos. O PAN também pode inibir a fotossíntese, causando a morte das plantas.
Videoaula sobre poluição do ar e problemas ambientais
Veja um resumo simples e rápido com o professor Carrieri , do canal Curso Enem Gratuito, sobre o que ocorre nas grandes cidades com a poluição e a degradação do meio ambiente:
O que é chuva ácida
Uma das consequências da poluição do ar é a chuva ácida. A chuva ácida é aquela com a presença de ácido sulfúrico, ácido nítrico e nitroso, resultantes de reações químicas que ocorrem na atmosfera.
É importante ressaltar que toda chuva contém um pequeno grau natural de acidez, mas não gera danos à natureza. O problema é que o lançamento de gases poluentes na atmosfera por veículos automotores, indústrias, usinas termelétricas, entre outros, tem aumentado a acidez das chuvas.
Causas da chuva ácida
O enxofre e o nitrogênio são os dois principais compostos que estão na origem da chuva ácida. Em seguida você confere como eles são formados.
Enxofre
O enxofre é uma impureza frequente nos combustíveis fósseis, principalmente no carvão mineral e no petróleo. Ao serem queimados, promovem a combustão desse composto de acordo com as seguintes reações químicas:
S (s) + O2 (g) —> SO2 (g)
2 SO2 (g) + O2 (g) —> 2 SO3 (g)
O enxofre e os óxidos de enxofre também podem ser lançados na atmosfera pelos vulcões.
Os óxidos ácidos formados reagem com a água para formar ácido sulfúrico (H2SO4), de acordo com a equação:
SO3 (g) + H2O (l) —> H2SO4 (aq)
Além disso, pode ocorrer a seguinte reação, formando-se ácido sulfuroso (H2SO3):
SO2 (g) + H2O (l) —> H2SO3 (aq)
Nitrogênio
O nitrogênio (N2) é um gás abundante na composição da atmosfera e muito pouco reativo. A fim de reagir com o oxigênio do ar, o nitrogênio precisa de grande quantidade de energia, como a que se liberta numa descarga elétrica ou no funcionamento de um motor de combustão. Esses motores são atualmente os maiores responsáveis pela reação de oxidação do nitrogênio.
Os óxidos, ao reagir com água, formam ácido nitroso (HNO2) e ácido nítrico (HNO3). Na câmara de combustão dos motores, ocorre a seguinte reação química:
N2 (g) + O2 (g) —> 2 NO (g)
O monóxido de nitrogênio (NO) formado na presença do oxigênio do ar produz dióxido de nitrogênio:
2 NO (g) + O2 (g) —> 2 NO2 (g)
Por sua vez, o dióxido de nitrogênio formado, na presença da água (proveniente da chuva), forma ácidos de acordo com a equação:
2 NO2 (g) + H2O (l) —> HNO3 (aq) + HNO2 (aq)
Quais as consequências da chuva ácida
- Para a saúde
A chuva ácida liberta metais tóxicos que estavam no solo. Esses metais podem contaminar os rios e serem inadvertidamente utilizados pelo homem causando sérios problemas de saúde.
- Nas casas, prédios e demais edifícios.
A chuva ácida também ajuda a corroer alguns dos materiais utilizados nas construções, danificando algumas estruturas, como as barragens, as turbinas de geração de energia, e também corrói veículos e monumentos históricos
- Para o meio ambiente
Os lagos podem ser os mais prejudicados com o efeito das chuvas ácidas, pois podem ficar totalmente acidificados perdendo toda a sua vida.
Contudo, a chuva ácida também provoca clareiras, matando algumas árvores de cada vez. Podemos imaginar uma floresta, que vai sendo progressivamente dizimada, podendo eventualmente ser até destruída.

- Para a agricultura
A chuva ácida afeta as plantações quase da mesma forma que as florestas. No entanto, a destruição é mais rápida, uma vez que as plantas são todas do mesmo tamanho e assim, igualmente atingidas pelas chuvas ácidas.
Inversão térmica
Os gases da atmosfera encontram-se em constante movimento gerado principalmente pelas correntes de convecção. Isso faz com que as partículas em suspensão no ar mais próximo à superfície (mais quente) sejam carregadas e dissipadas nas camadas mais altas e frias da atmosfera.
Esse processo ajuda a diminuir a poluição no ar próximo ao solo. Entretanto, no inverno pode ocorrer que uma massa de ar quente se estabeleça sobre determinada região.
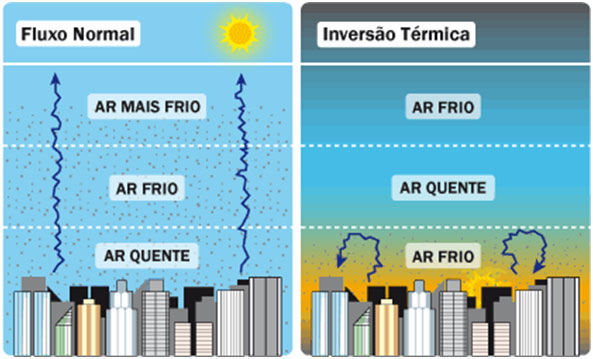
Assim, a atmosfera ficará com uma região mais fria próxima à superfície e outra em grandes altitudes e, no meio, uma camada de ar quente. Essa configuração da atmosfera dificulta as correntes de convecção e o ar mais próximo da superfície fica “preso” nesta região.
Dessa maneira, a poluição fica retida próximo à superfície, pois não consegue se dispersar nas camadas mais altas da atmosfera.
Videoaula sobre poluição e impacto ambiental
Acompanhe agora o resumo do professor Carrieri sobre o impacto ambiental e aumente seus conhecimentos sobre o assunto da aula. Em seguida, resolva os exercícios propostos.
Questões sobre poluição do ar, inversão térmica e chuva ácida
01 – (FUVEST SP/1989)
A concentração de gás carbônico na atmosfera vem aumentando significativamente desde meados do século XIX; estima-se que possa quadruplicar até o ano 2.000. Qual dos fatores abaixo é o principal responsável por esse aumento?
a) ampliação da área de terras cultivadas
b) utilização crescente de combustíveis fósseis
c) crescimento demográfico das populações humanas
d) maior extração de alimentos do mar
e) extinção de muitas espécies de seres fotossintetizantes.
02 – (UEL PR/2014)
Em um ambiente com elevado número de indústrias e de circulação de veículos, como as regiões metropolitanas, as partículas em suspensão e os gases poluentes são levados pelas correntes de convecção para as camadas mais altas da atmosfera, onde se dissipam. O fenômeno meteorológico da inversão térmica, que ocorre geralmente no inverno, tem como consequência o impedimento da dispersão dos poluentes, causando problemas respiratórios na população.
Assinale a alternativa que apresenta, corretamente, a causa da inversão térmica.
a) Uma massa de ar frio ascendente impede o movimento descendente de uma camada de ar quente.
b) Uma massa de ar quente descendente impede o movimento ascendente de uma camada de ar frio.
c) Uma massa de ar frio penetra entre camadas de ar quente, impedindo o movimento descendente do ar.
d) Uma massa de ar quente penetra entre camadas de ar frio, impedindo o movimento descendente do ar.
e) Uma massa de ar quente penetra entre camadas de ar frio, impedindo o movimento ascendente do ar.
03 – (UEM PR/2013)
Sobre as causas e as consequências da poluição atmosférica, assinale o que for correto.
01. A elevação dos níveis de poluentes na atmosfera traz uma série de desconfortos às pessoas, como irritação nos olhos e na garganta.
02. Devido às principais fontes de emissão do gás metano estarem relacionadas com a pecuária de bovinos e de ovinos e com a agricultura na várzea, elas também são responsáveis pela poluição atmosférica mundial.
04. O dióxido de enxofre (SO2) é um poluente atmosférico, sendo um gás tóxico proveniente da queima industrial de combustíveis como o carvão mineral e o óleo diesel.
08. As erupções vulcânicas lançam imensas quantidades de partículas sólidas na atmosfera e não chegam a interferir na formação de poluentes atmosféricos.
16. O gás ozônio (O3) presente nas altas camadas atmosféricas é benéfico à vida, mas, quando se forma próximo à superfície terrestre, é um poluente.
04 – (UNIRG TO/2013)
A poluição atmosférica tornou-se um problema de saúde pública em grandes capitais, principalmente durante o inverno. Os particulados presentes no ar inspirado estão associados ao surgimento de doenças como bronquite crônica e asma.
A incidência dessas doenças durante o inverno é maior porque:
a) a corrente de convecção dispersa os particulados pelas camadas terrestre e intermediária de ar frio.
b) a corrente de ar frio ascendente dispersa os particulados pela camada intermediária de ar quente
c) o efeito estufa concentra os particulados na camada intermediária de ar quente.
d) a inversão térmica concentra os particulados na camada terrestre de ar frio.
- B
- E
- 23
- D



