Você lembra o que é a energia de ativação? O blog do Enem te ajuda a relembrar com um super-resumo preparado especialmente para você! Se liga! Cai no Enem e nas provas dos vestibulares de todo Brasil.
Energia de ativação é a quantidade mínima de energia necessária para que ocorra a colisão de duas moléculas, em condições favoráveis, e aconteça a reação química.
Energia de ativação (Ea) é a diferença entre o máximo de energia e a energia dos reagentes, ou seja, é a barreira de energia que tem de ser ultrapassada para que a reação prossiga.
Essa energia determina a maneira como a velocidade de reação varia com a temperatura (equação de Arrhenius). É usual exprimir a energia de ativação em Joule por mol de reagentes.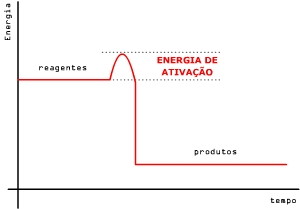
Quanto maior a energia de ativação mais lenta é a reação porque aumenta a dificuldade para que o processo ocorra. Quanto menor a energia de ativação menor a “barreira” de energia, mais colisões efetivas e, portanto uma reação mais rápida.
Quando a energia de ativação é atingida, forma-se primeiro o complexo ativado, que é uma estrutura intermediária e instável entre os reagentes e os produtos.
Resumindo Energia de Ativação para você aprender e não esquecer: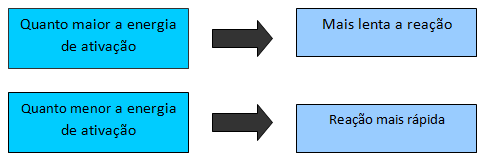
No complexo ativado, as ligações presentes nos reagentes estão enfraquecidas e as ligações presentes nos produtos estão se formando.
Entendeu o que é complexo ativado? Então observe abaixo o esquema para entender a Energia de Ativação: 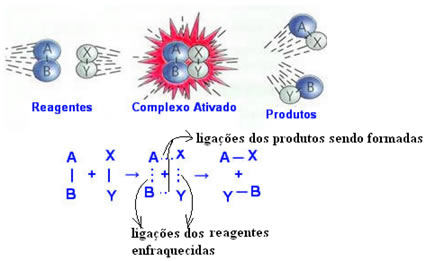 .
.
As reações só ocorrem quando os reagentes possuem energia de ativação. Como por exemplo, na reação do sódio metálico com a água, essas duas substâncias reagem violentamente, isso significa que a energia necessária desses reagentes já é suficiente para a reação ocorrer.
Já quando você vai acender um fogareiro, a reação de combustão só ocorre se colocarmos uma fonte de fogo perto do gás. Ou seja, é necessário fornecer energia ao sistema para que ele atinja a energia de ativação necessária para ocorrer a reação.
Aprenda mais!
Com os vídeos do Curso Enem Gratuito você pode ficar fera no conteúdo. Nossos professores explicam a energia de ativação pra você. Se liga nesse vídeo sobre as Colisões e prepare-se para responder nossos exercícios em seguida!
Dica 1– O que mais cai em Química nos Vestibulares no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2– Complemente os seus estudos revisando sobre as reações químicas. Acesse o nosso Blog do Enem e saiba tudo sobre esse assunto. https://blogdoenem.com.br/quimica-reacoes-quimicas/
Dica 3 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares que é Misturas. Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-misturas/
Exercícios
Agora um desafio:
No diagrama abaixo, o valor da energia de ativação correspondente em (Kcal):
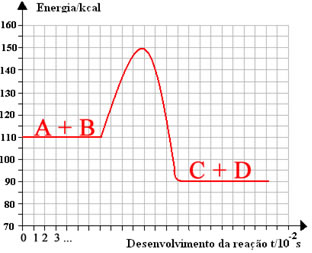
a) 25
b) 85
c) 110
d) 6
e) 40
Resposta: alternativa e
Como: Ea = E necessária para a reação inicie – E própria dos reagentes
Ea = 150-110 → Ea = 40 Kcal
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.


