Olá, quando você compra ovos e pede uma dúzia deles, você sabe exatamente a quantidade de ovos que está pedindo não é? Mas, como podemos expressar a quantidade de matéria que existe ali? Cai no Enem, e você precisa saber Mol e o Número de Avogadro. Veja abaixo.
A forma científica de você chegar ao cálculo da quantidade de matéria passa pelo conhecimento de Mol e o Número de Avogadro. Você lembra?
Ainda não sabe? Sem problemas. Dá tempo de aprender ou de recordar para chegar bem no Enem e no Vestibular. Revisão de Mol e Número de Avogadro com este resumo especial da professora Munique Dias e com os videos da Khan Academy. Siga.
Olá, aqui a professora Munique Dias. Que tal rever um dos assuntos de química que é o terror nas provas para os alunos? É isso mesmo! Estamos falando do Mol e do Número de Avogrado.
Antes de entrarmos diretamente no assunto de mol, e depois em Número de Avogadro (ou Constante de Avogadro), que tal relembrarmos algumas definições que serão importantes para o seu entendimento do conteúdo? Vamos nessa?
Molar: vem da palavra molécula.
Mas o que é molécula mesmo? Molécula é o conjunto de átomos que se ligam através das ligações químicas.
Massa Molar (M) ou massa molecular (MM) : É o calculo das massas atômicas dos átomos que compõe a molécula
Por exemplo, qual seria a massa molecular do Dióxido de carbono (CO2)?
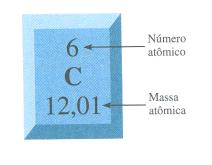
Primeiro é preciso saber qual é a massa atômica de cada átomo, que é dada pela Tabela Periódica dos elementos. Não lembra como? Observe a figura abaixo:
Massa atômica do carbono (C) = 6 u (unidade por massa atômica)
Massa atômica do oxigênio (O) = 16 u ( unidade por massa atômica)
Importante: De acordo com uma convenção internacional, massa atômica (às vezes chamada de peso atômico) é a massa de um átomo em unidades de massa atômica (u). Uma unidade de massa atômica é definida como a massa igual a exatamente 1/12 da massa de um átomo de carbono-12.
A massa molecular será a soma das massas atômicas dos átomos.
Obs.: O oxigênio da molécula de CO2 possui coeficiente 2, então é preciso multiplicar sua massa por 2.
Calculando:
Massa molecular do CO2 = 1 • 12 + 2.16 = 44 u
E a massa molar?? Como é calculada?
Assista agora ao vídeo do Curso Enem Gratuito em que o professor Sobis explica o que é o mol fazer o cálculo da Massa molar, e muito mais. Espero você para continuar com o post após o video. Tem muito mais para você aprender.
Dica 1 – Quer revisar um pouco sobre Átomos antes de continuar? Veja aqui uma aula completa de Introdução ao Átomo: https://blogdoenem.com.br/quimica-atomo-khan-academy/
Os átomos possuem massas muito pequenas e não existe balança que permita pesá-los diretamente em unidades de massa atômica. A ideia de usar uma unidade para representar um grande número de objetos não é nova. Por exemplo, um par (dois itens), uma dúzia (12 itens) e uma grosa (144 itens) são unidades familiares. Para os químicos, os átomos e moléculas são medidos em mol.
Portanto:
Mol: Quantidade de substância que contém tantas entidades elementares (átomos, moléculas ou outras partículas) quantas existe em, exatamente 12 g (ou 0,012 kg) do isótopo carbono-12.
O número de átomos existente em 12 g de carbono-12 foi determinado experimentalmente e denomina-se número de Avogadro (NA) em honra ao cientista italiano Amedeo Avogadro. O valor, atualmente aceito, para esse número é: 6.0221367 x 1023
Dica 2- Quer saber mais sobre mol e número de Avogrado? Assista a vídeo-aula gratuita do Canal Descomplica e saia na frente nas provas do Enem e dos vestibulares. http://www.youtube.com/watch?v=Us6xhEjRtVw
Portanto: a massa molar é a massa de 6,02 x 1023 entidades químicas, e é expressa em g/mol.
Exemplo:
H2S
Massa Molecular = 34,1 u
Massa molar (M) = 34,1 g/mol
Isto quer dizer que em 34,1 g/mol de Gás Sulfídrico tem 6,02 x 1023 moléculas, ou 1 mol de moléculas de Gás Sulfídrico.