Aprenda agora como é o funcionamento das reações eletroquímicas. Elas transformam energia química em energia elétrica, e vice-versa. As Pilhas e Baterias têm estas reações de oxidação ou redução.
Você sabe que tipo de reação química ocorre numa pilha? São reações da Eletroquímica, onde acontece a transformação de nergia Química em Energia Elétrica. E você sabe como ela gera corrente elétrica? É conteúdo frequente nos vestibulares e no Enem. Veja aqui com a professora Munique Dias.
Reações de Oxidação e Redução
Dispositivos capazes de transformar energia química em energia elétrica por meio de reações espontâneas de oxirredução (em que há transferência de elétrons).
Confira agora no resumo da professora de química Larissa Santos, do canal do Curso Enem Gratuito:
Você sabe qual é a diferença entre uma pilha e uma bateria? Que tal relembrar? Cai nas provas dos vestibulares e no próximo Enem.
A diferença está no fato de que as pilhas possuem apenas um eletrólito (solução condutora de íons também denominada de ponte salina) e dois eletrodos. Já a bateria é composta de várias pilhas agrupadas em série ou em paralelo. Além disso, as pilhas não são recarregáveis, mas as baterias são.
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Mas como são formadas as pilhas?
As pilhas são sempre formadas por dois eletrodos e um eletrólito.

- O eletrólito é também chamado de ponte salina e é a solução condutora de íons. Tem a finalidade de manter as duas semicelas eletricamente neutras através da migração de íons.
Como funcionam as Pilhas e Baterias
Confira agora com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito:
Não se lembra de oxidação e redução? Quer relembrar? Então acesse o nosso blog do Enem e estude através de uma super-revisão preparada pela professora Munique Dias especialmente para você. Não deixe de revisar! https://blogdoenem.com.br/quimica-enem-khan-academy-2/
Dica 2 – Veja dicas de revisão para o vestibular em 4 semanas! No site http://www.examtime.com.br/revisao-para-o-vestibular/
Para que você entenda melhor o blog do Enem preparou um esquema simplificado de uma pilha. Olhe e entenda como funciona! Cai nas provas dos vestibulares e do Enem.
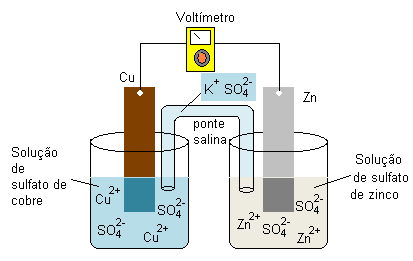
Quer relembrar ainda mais sobre Pilhas? Assista a vídeoaula totalmente gratuita do Descomplica sobre pilhas, e mande ver nas provas dos vestibulares e no próximo Enem.
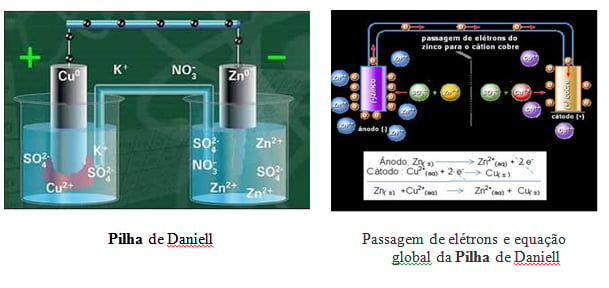
A PILHA DE DANIELL

John Frederic Daniell (1790-1845), químico criador da famosa pilha de Daniell
A pilha de Daniell é constituída de uma placa de Zinco (Zn) em uma solução de ZnSO4 e uma placa de Cobre (Cu) em uma solução de CuSO4. As duas soluções são ligadas por uma ponte salina, ou por uma parede porosa.
Pólos da pilha
Pólo positivo – o de menor potencial de oxidação – Cu.
Pólo negativo – o de maior potencial de oxidação – Zn.
Cátodo e Ânodo
Cátado – placa de menor potencial de oxidação – Cu. Onde ocorre redução.
Ânodo – placa de maior potencial de oxidação – Zn. Onde ocorre oxidação.
Variação de massa nas placas
Placa de maior potencial de oxidação – diminui – Zn.
Placa de menor potencial de oxidação – aumenta – Cu.
Equação global da pilha
Zn(s) + Cu(aq)+2 → Zn(aq)+2 + Cu
A pilha de Daniell é representada pela seguinte notação:
Zn°/Zn2+//Cu2+/Cu°
Ânodo – Ponte Salina ( // ) – Cátodo
A representação ou notação química de uma pilhas é feita obedecendo a seguinte regra:

Assim, para a pilha de Daniell temos:
Zn / Zn2+// Cu2+ / Cu
Quer saber mais sobre a pilha de Daniell? Assista a vídeo aula do prof Felipe Sobis, e fique fera nesse assunto!
“Determine que algo pode e deve ser feito, e então você achará o caminho para faze-lô”
Abraham Lincoln
Os textos e exemplos de apresentação desta revisão sobre pilhas foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e atualmente cursa o doutorado em Engenharia Química, também pela UFSC. Facebook: https://www.facebook.com/Munique .

Agora que você já sabe tudo sobre Química, que tal conhecer nossa rede de blogs?
Gostou do post? Use os botões abaixo e ao lado para espalhar por suas redes sociais.
Facebook: /RedeEnem (Clique AQUI para saber como receber TUDO sobre o Enem)

