Você lembra o que acontece quando misturamos um ácido com uma base? Isso mesmo ocorre uma Reação de Neutralização! Vamos relembrar? Cai no Enem e nos vestibulares de todo Brasil. Confira abaixo revisão com aulas gratuitas.
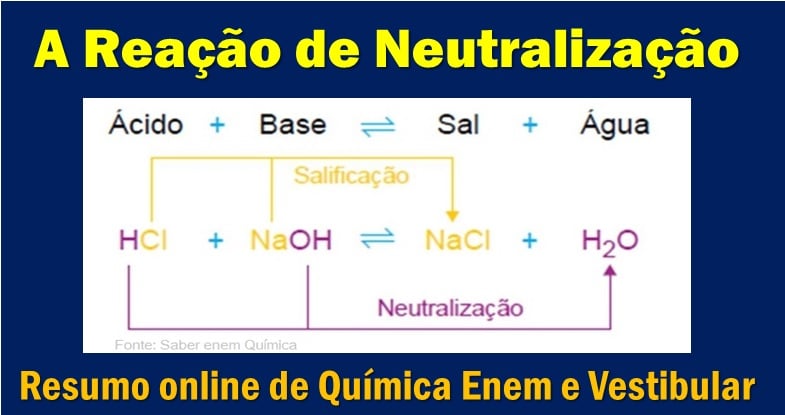
A Reação de Neutralização ocorre entre um Ácido e uma Base. É um componente clássico do conteúdo de Química para as provas do Enem e dos Vestibulares. Bora lá revisar para ‘matar esta’ quando aparecer na sua frente.
Uma Reação de Neutralização surge da mistura de um ácido e uma base. Esta reação origina como produto água e um sal. Você se recorda? Se ainda não veio na sua cabeça é porque precisa mesmo de uma revisão.
Vamos lá para a primeira dúvida e resposta: Mas o que exatamente está presente em um ácido e uma base e que faz com que um neutralize o outro? Antes de responder veja esta imagem para entender o que acontece: 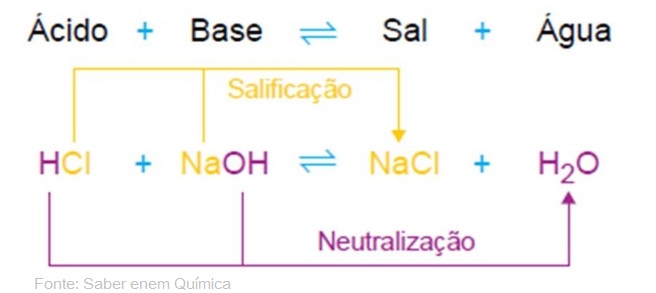 Em outras palavras, para você compreender: Uma reação de neutralização é caracterizada pela reação química entre um ácido que é capaz de ionizar-se, produzindo no mínimo um cátion hidrônio H+ e uma base, capaz de dissociar-se, liberando no mínimo um ânion hidroxila OH–, resultando como produtos um sal e água.
Em outras palavras, para você compreender: Uma reação de neutralização é caracterizada pela reação química entre um ácido que é capaz de ionizar-se, produzindo no mínimo um cátion hidrônio H+ e uma base, capaz de dissociar-se, liberando no mínimo um ânion hidroxila OH–, resultando como produtos um sal e água.
Ou Seja, o segredo está nos íons presentes: H+ e OH-. Para que ocorra a neutralização total do ácido e da base é preciso que a quantidade de íons OH- seja igual à quantidade de íons H+, o que pode ser verificado na equação que representa o processo: ![]() 1 H+ + 1 OH– → 1 H2O
1 H+ + 1 OH– → 1 H2O
Relembre aqui sobre os Ácidos e as Bases acessando o Blog do Enem e estudando com um super-resumo que preparamos para você, não deixe de conferir! Veja na imagem aula gratuita de Ácidos e Bases: Veja nesta aula acima as definições clássicas de Ácidos e Bases (Arrhenius): Ácidos são Substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+). As Bases são Substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
Veja nesta aula acima as definições clássicas de Ácidos e Bases (Arrhenius): Ácidos são Substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+). As Bases são Substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
A Reação de Neutralização > Para entender como o meio é neutralizado, pense, por exemplo, no limão que possui ácido cítrico, cujo pH é de aproximadamente 3,0. Já o leite de magnésia é básico e seu pH é em torno de 10,0. ![]() Se formos adicionando o limão gota a gota no leite de magnésia, o valor do pH do suco de limão irá subir progressivamente, ou seja, ele estará sendo neutralizado. Chegará um momento em que todos os átomos de hidrogênios ionizáveis (H+) do ácido cítrico do limão estarão na mesma quantidade que os ânions hidróxidos (OH–). Nesse momento ocorre a neutralização total.
Se formos adicionando o limão gota a gota no leite de magnésia, o valor do pH do suco de limão irá subir progressivamente, ou seja, ele estará sendo neutralizado. Chegará um momento em que todos os átomos de hidrogênios ionizáveis (H+) do ácido cítrico do limão estarão na mesma quantidade que os ânions hidróxidos (OH–). Nesse momento ocorre a neutralização total. 
A formação de Cloreto de Sódio (NaCl), nosso conhecido sal de cozinha, é um exemplo clássico de reação de neutralização, acompanhe os passos necessários para que ela ocorra: 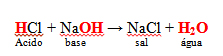 Primeiramente é preciso que se formem os íons que irão participar da reação, eles são provenientes de um ácido (HCl) e uma base (NaOH):
Primeiramente é preciso que se formem os íons que irão participar da reação, eles são provenientes de um ácido (HCl) e uma base (NaOH):
HCl → H+ + Cl-
NaOH → Na+ + OH-
A dissociação das moléculas de HCl e NaOH produzem ânions (Cl- e OH-) e cátions (H+ e Na+). A junção entre os íons acima é que vai originar Cloreto de sódio.
- 1 H+ Cl- + 1 Na+ OH- →1 NaCl +1 H2O
- Produtos da reação de neutralização: NaCl + H2O
Essa reação de Neutralização é chamada de NEUTRALIZAÇÃO TOTAL, pois a quantidade de íons H+ liberados pelo ácido é igual à quantidade de íons OH- liberados pela base. No caso do exemplo acima, foram liberados um H+ e um OH-.
Aula Gratuita sobre a Reação de Neutralização
Saiba mais sobre a reação de neutralização assistindo a vídeo aula do Descomplica ministrada pelo professor Marcelo Cruz. Não fique de fora dessa!
Dica do Blog do Enem – Complemente seus estudos revendo outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Indicadores ácido base. Acesse o nosso blog do Enem e veja um super- resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-acido-base/
Saiba ainda mais sobre a reação de Neutralização e gabarite as questões de química referente a esse assunto. Assista a videoaula da Oficinadoestudante e veja os exemplos que o professor Paulo preparou para você. Não deixe de estudar! Cai no Enem e nos vestibulares de todo Brasil.