As substâncias iônicas são aquelas que possuem pelo menos uma ligação iônica, ou seja, quando há transferência definitiva de elétrons de um dos átomos para outro, formando íons. Veja aula gratuita.
Vamos revisar um pouco sobre as substâncias iônicas? O blog do Enem te ajuda a estudar. Fique ligado! Cai no Enem e também nas provas de vestibulares de todo o Brasil.
As substâncias iônicas são aquelas que possuem pelo menos uma ligação iônica, ou seja, quando há transferência definitiva de elétrons de um dos átomos para outro, formando íons. 
Você lembra o que é um íon? – Confira aqui para recuperar este conteúdo: – Íons são átomos em desequilíbrio elétrico e apresentam carga positiva ou negativa. O átomo do elemento que perdeu os elétrons fica com carga positiva e é um íon chamado de cátion, enquanto o átomo que recebeu os elétrons, ficando com carga negativa, é o ânion.
Arranjos entre compostos iônicos formam substâncias iônicas, também chamadas de compostos iônicos. A união entre os íons acontece em consequência das forças de atração eletrostática, elas ocorrem a todo o momento ao nosso redor, onde existem cargas elétricas de sinais opostos se atraindo.
Confira também o nosso resumo sobre ligações químicas que irá te ajudar a compreender melhor as substâncias iônicas. Não deixe de conferir!
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
A atração entre os íons produz aglomerados com formas geométricas definidas que recebem o nome de retículos cristalinos. Nesse retículo, cada ânion atrai simultaneamente vários cátions e cada cátion também atrai simultaneamente vários ânions.
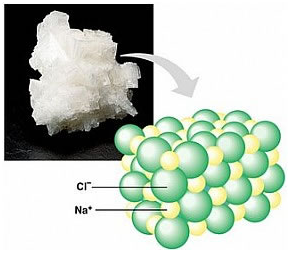
O sal (NaCl) é um exemplo de uma substância iônica e como todo composto iônico, apresenta-se na forma de um retículo cristalino.
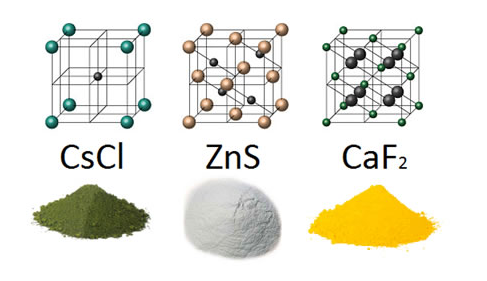
- Alguns exemplos de outras substâncias iônicas e seus retículos cristalinos:
- CsCl – Cloreto de Césio
- ZnS – Sulfeto de Zinco
- CaF2 – Fluoreto de Cálcio

Propriedades das substâncias iônicas:
· Apresentam alto ponto de fusão (PF) e ponto de ebulição (PE).
• São sólidas à temperatura ambiente (25°C) e apresentam forma definida.
• Quebram-se facilmente quando são submetidas a impactos, e produzem faces planas, são, portanto, cristais duros e quebradiços.
• O melhor solvente dessas substâncias é a água.
• Conduzem corrente elétrica no estado líquido (fundido) e quando estão dissolvidas em água. Essa propriedade é devido à existência de íons com liberdade de movimento.
Saiba ainda mais sobre as substâncias iônicas assistindo as partes 1 e 2 da videoaula do professor Guilherme Faht, e nunca mais esqueça esse conteúdo, Vamos lá!