Veja as Leis da Termodinâmica. É conteúdo que sempre cai nas questões de Física nos vestibulares e no Enem. Confira aula gratuita com exercícios.
Revisão das Leis da Termodinâmica – Conteúdo de Física para o Enem e o Vestibular. Confira.
Nesta aula iniciaremos o estudo da termodinâmica. A termodinâmica, palavra de origem grega que significa “movimento de calor”, é a área da Física em que investigamos os processos pelos quais calor pode ser convertido em trabalho mecânico ou vice-versa por meio de um gás. Na Termodinâmica relacionaremos as propriedades macroscópicas de um gás (pressão, volume e temperatura) com a energia trocada entre esse gás e outros sistemas.
As leis da termodinâmica, elaboradas no século XIX depois de exaustivas experimentações, explicam a natureza dos processos termodinâmicos, reconhecem a existência de limites e são de fundamental importância em todos os ramos da física e da engenharia.
A energia interna de um gás e a lei de Joule
As moléculas de um gás, como já sabemos, estão em um constante estado de movimentação caótica e desordenada. Sabemos ainda que essa movimentação depende da temperatura do gás; quanto mais alta for a temperatura do gás, maior será o estado de agitação de suas moléculas, maior será a velocidade e, consequentemente, a energia cinética dessas moléculas.
Dica 1 – O conceito de Gás Ideal é meramente teórico, pois gases deste tipo não existem na prática, não deixe de estuda-lo. Estude Gás Ideal nesta aula de Física Enem – https://blogdoenem.com.br/o-modelo-gas-ideal-fisica-enem/
A energia interna de uma dada massa de gás, que passaremos a representar por U, corresponde à soma de várias parcelas, entre as quais podemos citar a energia cinética média das moléculas, a energia potencial de configuração, relacionada às forças intramoleculares, e a energia cinética de rotação das moléculas e das partículas elementares presentes nos átomos.
Com o auxílio das leis da mecânica e da equação de Clapeyron, pode-se demonstrar que a energia interna U de uma dada massa de gás perfeito monoatômico pode ser calculada por:
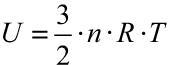
Nessa expressão, U é a energia interna do gás, n é o número de mols do gás, T sua temperatura absoluta (em kelvins) e R a constante universal dos gases perfeitos.
A partir da expressão anterior, podemos enunciar uma lei, conhecida como lei de Joule, para os gases perfeitos.
A energia interna de uma dada massa de gás perfeito depende exclusivamente de sua temperatura absoluta T.
Portanto, a energia interna U é diretamente proporcional à temperatura absoluta T do gás. Entretanto, na termodinâmica não se costuma fazer a quantificação direta da energia interna do gás, mas sim de sua variação ΔU. Assim, podemos ter:
• se a temperatura do gás aumentar, então U aumentará e ΔU > 0;
• se a temperatura do gás diminuir, então U diminuirá e ΔU < 0;
• se a temperatura do gás não variar (transformação isotérmica), então U não variará e ΔU = 0.
Variação da Energia – Importante!
Note que a variação da energia interna depende apenas do estado inicial e do estado final do gás. Ou seja, a variação da energia interna de um gás não depende das transformações sofridas pelo gás ao passar do estado inicial para o estado final.
Trabalho numa transformação gasosa
A grandeza física trabalho (de uma força) é uma medida da quantidade de energia transferida de um corpo para outro por meio de uma força. De maneira simplificada, podemos dizer que uma força realiza trabalho sobre um corpo quando ela consegue provocar um deslocamento no corpo.
Dica 2 – A troca de calor pode acontecer de três maneiras: por condução; convecção ou por irradiação. Revise sobre Transmissão de Calor nesta aula de Física Enem – https://blogdoenem.com.br/transmissao-de-calor-fisica-enem/
Quando, durante uma transformação termodinâmica, o volume V de um gás sofrer uma variação ΔV, haverá a realização de um trabalho τ e, consequentemente, troca de energia mecânica com o meio externo. A realização de trabalho durante a transformação gasosa pode, então, ser interpretada como uma medida da energia trocada pelo sistema gasoso com o meio externo, sem a necessidade de uma diferença de temperatura.
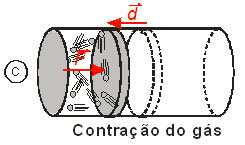
Consideremos uma determinada quantidade de gás contida em um cilindro provido de êmbolo que pode deslizar sem atrito, como mostrado na figura a, abaixo.
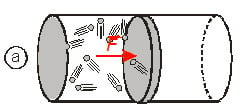
Os choques das moléculas do gás contra o êmbolo resultam numa força ![]() e, se o gás sofrer uma expansão, essa força e o êmbolo se deslocarão no mesmo sentido, como mostrado na figura b. Portanto, o trabalho τ é positivo e dizemos que o gás realizou trabalho.
e, se o gás sofrer uma expansão, essa força e o êmbolo se deslocarão no mesmo sentido, como mostrado na figura b. Portanto, o trabalho τ é positivo e dizemos que o gás realizou trabalho.
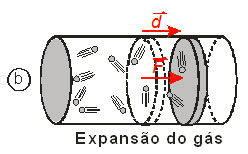
Se o gás sofrer uma contração de volume, então, a força ![]() e o êmbolo se deslocarão em sentidos opostos, como mostrado na figura c. Nesse caso, o trabalho τ é negativo e dizemos que o gás recebeu trabalho.
e o êmbolo se deslocarão em sentidos opostos, como mostrado na figura c. Nesse caso, o trabalho τ é negativo e dizemos que o gás recebeu trabalho.
Vamos agora obter uma expressão para calcular o trabalho τ em uma transformação gasosa. Para simplificar, consideraremos uma expansão isobárica do gás, ou seja, um aumento de volume sob pressão constante.
Nesse caso, a força ![]() é constante, pois
é constante, pois ![]()
e, portanto, F = p • S, em que S é a área do êmbolo.
Para uma força ![]() constante, o trabalho τ é dado por: τ = F • d.
constante, o trabalho τ é dado por: τ = F • d.
Então: τ = F • d![]() τ = p • S • d.
τ = p • S • d.
Entretanto, o produto S • d na expressão acima corresponde à variação de volume ΔV sofrida pelo gás.
Dica 3 – Se você não sabe que a trajetória dos planetas é elíptica, então estude sobre as Leis de Gravitação e fique preparado para gabaritar na prova de Física Enem – https://blogdoenem.com.br/leis-de-gravitacao-de-kepler-fisica-enem/
Portanto, numa transformação isobárica de um gás perfeito:
![]()
(válida apenas quando p permanece constante)
Observe que o sinal do trabalho τ depende do sinal da variação de volume ΔV do gás:
• se ΔV > 0, então V aumenta e τ > 0 (o gás realiza trabalho);
• se ΔV < 0, então V diminui e τ < 0 (o gás recebe trabalho);
• se ΔV = 0, então V não varia e τ = 0 (o gás não realiza e nem recebe trabalho e a transformação é isocórica).
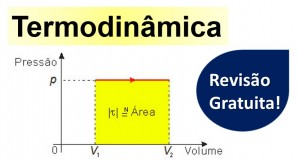
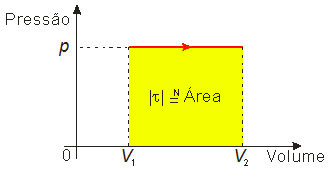
A representação de uma transformação gasosa em um diagrama Pressão p × Volume V recebe o nome de diagrama de Clapeyron ou diagrama de trabalho.
No caso de uma transformação isobárica, o diagrama de Clapeyron é uma reta paralela ao eixo dos volumes e o trabalho na transformação, τ = p • ΔV, corresponde, numericamente, à área do retângulo destacado na figura a seguir.
Essa propriedade pode ser generalizada e é válida mesmo que a pressão p exercida pelo gás durante a transformação varie.
Então, em qualquer transformação gasosa:
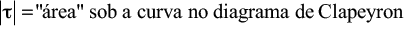
Na expansão, τ > 0 e o gás realiza trabalho.
Na contração, τ < 0 e o gás recebe trabalho.
Saiba mais sobre Termodinâmica nas aulas dos nossos professores do canal Curso Enem Gratuito, disponíveis no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios
Questão 1
(Udesc–SC) O gráfico abaixo apresenta dois processos termodinâmicos distintos, utilizados para levar uma massa gasosa de gás ideal de uma temperatura inicial T0 até uma temperatura Tx. O primeiro (A) é um processo isobárico e o segundo (B) é um processo isocórico.
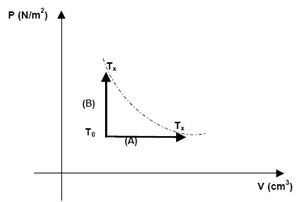
Analise as afirmativas abaixo, relacionadas aos processos termodinâmicos descritos no gráfico:
I. A variação de energia interna do gás foi a mesma nos dois processos.
II. A quantidade de calor fornecida ao gás foi a mesma nos dois processos.
III. A temperatura Tx é maior do que a temperatura T0.
Assinale a alternativa correta.
a) Somente a afirmativa III é verdadeira.
b) Somente as afirmativas I e II são verdadeiras.
c) Somente as afirmativas I e III são verdadeiras.
d) Somente a afirmativa II é verdadeira.
e) Todas as afirmativas são verdadeiras.
Questão 2
(UFPE) A figura ilustra duas câmaras, A e B, de volumes constantes, VA = V/3 e VB = 2V/3. Os gases no interior das câmaras encontram-se inicialmente a temperaturas distintas. As câmaras encontram-se separadas uma da outra por uma parede fixa, que permite a troca de calor entre os seus respectivos gases. Um isolante térmico impede a troca de calor dos gases com o meio exterior.
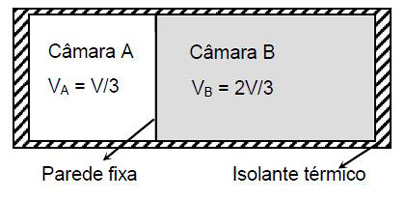
Ao se atingir o equilíbrio térmico, os gases das câmaras sofreram variações de energia interna denotadas por ΔEA e ΔEB. A razão ΔEA/ΔEB vale:
a) zero
b) –1
c) –1/3
d) –2/3
e) –2
Questão 3
(UFPR) Uma amostra de um gás considerado perfeito é levada do estado A ao estado C, segundo a transformação ABC indicada na figura a seguir.
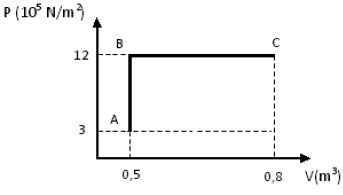
Sabendo-se que 1 cal = 4,18 J, o trabalho realizado pelo gás durante a transformação será aproximadamente de:
a) 86,1 kcal.
b) 8,61 kcal.
c) 0,861 kcal.
d) 0,861 cal.
e) 0,00861 cal.
Questão 4
(UFPA) Ao encher o pneu de uma bicicleta o borracheiro comprime rapidamente o ar para o interior do pneu, ocorrendo assim um processo adiabático. O gráfico abaixo representa esse fenômeno, em um diagrama de pressão-volume.
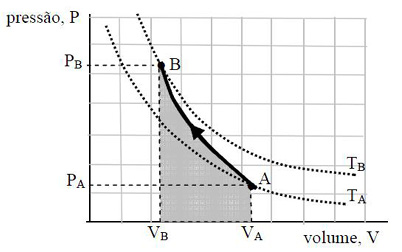
Considerando o fenômeno referido e o gráfico acima, julgue as afirmações:
I – A área destacada sob a curva mede numericamente o trabalho realizado na transformação adiabática.
II – A pressão P e o volume V, em um processo adiabático, relacionam-se pela Lei de Boyle.
III – Sendo um processo de compressão adiabática, então, o volume e a temperatura diminuem.
IV – Se TA e TB são, respectivamente, as isotermas das temperaturas inicial e final do processo, então TB > TA.
Estão corretas apenas,
a) I e II.
b) II e III.
c) III e IV.
d) I e III.
e) I e IV.
Questão 5
(UFJF–MG) Aumenta-se a pressão de certa quantidade de gás ideal, inicialmente à pressão P1, volume V1 e temperatura T1, através de dois processos diferentes. No primeiro processo, o gás é aquecido com o volume do gás mantido constante até a pressão dobrar de valor. No segundo processo, o gás, partindo das mesmas condições iniciais (P1, V1, T1) é resfriado à pressão constante até o volume ser reduzido à metade e depois, mantendo constante o volume reduzido, é aquecido até que a pressão dobre de valor. Sobre esses dois processos, podemos afirmar que:
a) a temperatura final atingida em ambos os processos é a mesma.
b) a variação da energia interna do gás em ambos os processos é a mesma.
c) o trabalho realizado sobre o gás em ambos os processos é o mesmo.
d) a temperatura final atingida no primeiro processo é maior que a temperatura final atingida no segundo processo.
e) o trabalho realizado sobre o gás, no primeiro processo, é diferente de zero.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!



