CNTP - Condições Normais de Temperatura e Pressão - Estude sobre os fatores que influenciam na velocidade uma reação química. Confira a Natureza dos Reagentes em mais uma aula preparatória para as questões de Química no Enem
Você lembra da Natureza dos Reagentes nas aulas práticas no Laboratório de Química da sua escola? Ou, então, mesmo nas aulas teóricas? Vamos lá, é hora de recuperar este conteúdo!
O que é um ‘Reagente’? – Resposta direta: Os reagentes são as substâncias que são ‘consumidas ou processadas’ durante uma determinada reação química. É a partir da ‘reação’ entre os reagentes que surgem os Produtos da reação química. Em outras palavras: a combinação e a reação ‘entre’ os reagentes é que gera o Produto da reação, gerando a nova composição. E, para ocorrer a reação, há sempre que se considerar as tradicionais CNPT: Condições Normais de Temperatura e Pressão, e os fatores que podem alterar as condições!
Mas, fique de olho: Em algumas reações químicas nós temos os ‘catalisadores’ e os ‘solventes’, e que apenas criam as condições para ocorrer ou acelerar a reação entre os reagentes. Porém, os catalisadores e os solventes não são ‘reagentes’. Eles atuam na Cinética Química, mas não formam parte dos reagentes e nem dos produtos. Veja uma aula especial sobre Cinética Química e a velocidade das reações antes de continuar: 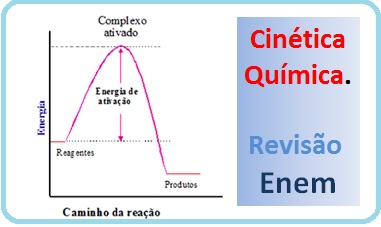
A Natureza dos Reagentes – Para você entender, e nunca mais esquecer: Quanto mais átomos são necessários separar para ocorrer uma reação química, menor será a velocidade da reação. Ou seja, se para ocorrer uma determinada reação for preciso o rompimento (ou a quebra) de ligações nos reagentes, e se estas ligações forem ‘fortes’, tanto mais lenta será a reação. Mas, em muitos casos é possível ‘ajudar’ ou ‘acelerar’ a reação. Veja:
Aceleradores, Catalisadores e Fontes de Energia
1 – Luz (energia fotoquímica) e eletricidade (energia elétrica)
A luz e a eletricidade são fontes de energia para que a reação ocorra, logo, sob influência de intensidades luminosas e/ou elétricas maiores, maior a velocidade da reação. Exemplo: A Fotossíntese e a Fotólise (nas máquinas fotográficas antigas, filmes e chapas fotográficas).
2 – Superfície de contato
Quanto maior a superfície de contato entre os reagentes, maior a velocidade das reações.
3 – Estados físicos dos reagentes
Reações onde os reagentes encontram-se no estado gasoso, ou em solução aquosa são mais rápidas. Quanto mais próximos os átomos e moléculas, maior o impedimento estérico (espacial) para que os reagentes se colidam. O solvente auxilia a separar as moléculas e possibilita que as colisões efetivas ocorram. 
4 – Pressão
Para reações gasosas, quanto maior a pressão, maior será o número de colisões entre os reagentes, logo mais colisões efetivas ocorrem em um período de tempo menor, o que aumenta a velocidade da reação.
5 – Temperatura
O aumento da temperatura provoca um aumento na energia cinética dos reagentes, provocando um aumento no número de moléculas e partículas com energia suficiente para que a reação ocorra. Logo, tanto para reações endotérmicas como exotérmicas, o aumento da temperatura aumenta a velocidade da reação. (Regra de van’t Hoff)
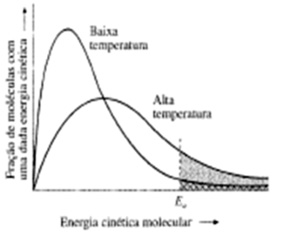
5 – Concentração dos reagentes
Quanto maior a concentração dos reagentes, maior a probabilidade de ocorrerem “colisões efetivas” o que aumenta a velocidade da reação.
7 – Catalisador
É uma substância que aumenta a velocidade de uma reação, diminuindo a energia de ativação para a reação. Observação importante: O catalisador altera o caminho reacional, porém não modifica a entalpia da reação.
Dica 2 – Revise com a gente sobre as Propriedades coligativas das soluções nesta aula de Química Enem. O Exame Nacional do Ensino Médio está chegando! – https://blogdoenem.com.br/propriedades-coligativas-das-solucoes-quimica-enem/
O mesmo é regenerado ao final da reação.
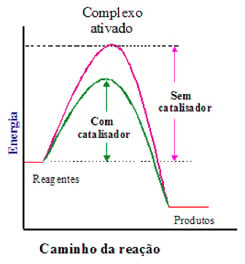
Gráfico incorreto
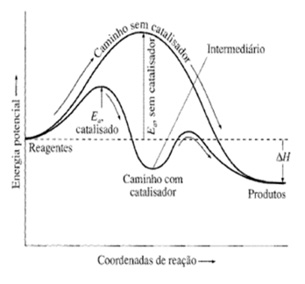
Gráfico correto
Catálise – reação com presença de catalisador
Catálise homogênea – ocorre quando o catalisador forma um sistema monofásico com os reagentes. Reagentes e catalisadores na mesma fase.
Catálise heterogênea – ocorre quando o catalisador forma um sistema com mais de uma fase com os reagentes. Catalisado em diferente fase que os reagentes.
8 – Inibidor
Catalisador negativo ou veneno da reação. Aumenta a energia de ativação de uma reação, de modo a diminuir a velocidade de uma reação. O inibidor pode se ligar ao sítio ativo da reação o inativando.
Aula Gratuita
Saiba mais sobre os fatores que modificam a velocidade de uma reação nesta aula do canal Curso Enem Gratuito, em que o professor Sobis explica melhor sobre esse assunto para você revisar e se aprofundar. Após assistir, responda os nossos desafios!
Desafios
Questão 1
(UFSM) Um comprimido efervescente de vitamina C intacto, pesando 5 g, quando colocado em um copo contendo água a 25 ºC, será dissolvido em dois minutos.
Considerando essa informação, assinale verdadeiro (V) ou falso (F) em cada uma das proposições.
( ) Se o comprimido efervescente estiver em pequenos pedaços, o tempo de dissolução também será de dois minutos, pois a massa continua sendo 5 g.
( ) O tempo de dissolução do comprimido efervescente intacto mantém-se quando o comprimido for dissolvido em água a 40 ºC ou a 25 ºC, pois a área de contato é a mesma.
( ) Quanto maior a superfície de contato do comprimido efervescente com a água, maior o número de colisões favoráveis, portanto maior a velocidade de dissolução.
( ) O aumento da temperatura diminui a energia de ativação, diminuindo, portanto, o tempo de dissolução.
A sequência correta é:
a) V-F-V-V;
b) F-V-F-V;
c) V-V-F-V;
d) F-F-V-F;
e) V-V-F-F.
Dica 3 – Você sabe tudo sobre Concentração das Soluções? Revise com mais esta aula preparatória para a prova de Química Enem! – https://blogdoenem.com.br/concentracao-das-solucoes-quimica-enem/
Questão 2
A água é uma das mais importantes substâncias do planeta Terra, tanto para os processos vitais como para os físico-químicos. No estado líquido e sólido, cobre mais de dois terços do pleneta e, na forma gasosa, é constituinte da atmosfera. Os organismos vivos originaram-se em meio aquoso e se tornaram dependentes dele no decurso da evolução. A água é o solvente universal, pois possibilita a maioria das reações químicas. Assim, o conhecimento de suas propriedades físico-químicas é essencial para o estudo de suas funções na natureza.
REICHARDT, K, TIMM, L. C. Solo, Planta e Atmosfera: conceitos, processos e aplicações. São Paulo: Ed. Manole, 2004. (adaptado)
Considere a reação:
2H2(g) + O2(g) 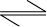 2H2O(g)
2H2O(g)
Considere a reação citada inicialmente e assinale V (verdadeira) ou F (falsa) nas afirmações a seguir.
( ) A adição de um catalisador afeta a entalpia da reação
( ) A adição de um catalisador aumenta a velocidade de formação de H2O(g) e não é consumido no processo.
( ) A adição de um catalisador faz com que um maior número de moléculas de H2(g) e O2(g) adquira condições de reagir, pois reduz a energia de ativação.
A sequência correta é:
a) F – V- F
b) F – V – V
c) V – F – V
d) F – F – F
e) V – F – F
Questão 3
Para aumentar a octanagem dos combustíveis, pode ser usado um catalisador contendo platina finamente dividida, suportada em Al2O3. Nesse caso, o pentano contido na gasolina, que tem um teor de octanas de 62, transforma-se em 2-metilbutano, com teor de octanas de 94.
Assim, analise as afirmações
I. Platina suportada em Al2O3 aumenta a velocidade da reação sem ser consumida durante o processo.
II. Trata-se de um caso de catálise heterogênea, pois nem todos os componentes se encontram na mesma fase.
III. A energia de ativação da reação não sofre modificação pela adição do catalisador.
Está(ão) correta(s)
a) apenas I
b) apenas II
c) apenas III
d) apenas I e II
e) apenas II e III
Questão 4
Na pólvora, o salitre (KNO3), o carvão e o enxofre são utilizados na sua forma pulverizada. Analise as seguintes afirmações em relação à velocidade de explosão da pólvora:
I. Na temperatura ambiente, a velocidade é rápida, pois a energia de ativação é alta.
II. A velocidade depende apenas da temperatura.
III. A pulverização dos reagentes aumenta a velocidade.
Está(ão) correta(s)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas II e III.
Questão 5
A queima de gasolina nos motores produz, em maior quantidade, dióxido de carbono (CO2) e água. Porém, devido a impurezas na gasolina, são formados também os seguintes subprodutos (poluentes e tóxicos): monóxido de carbono (CO), óxidos de nitrogênio (NOx) e dióxido de enxofre (SO2).
Para diminuir a emissão, os escapamentos dos automóveis foram aperfeiçoados. A fabricação desses escapamentos é realizada de modo que espécies químicas (principalmente metais preciosos, paládio-molibdênio) são adicionadas na fabricação deles.
Esses metais auxiliam na transformação dos poluentes (CO, NOx) em compostos menos prejudiciais à saúde (CO2 e N2). Tais metais atuam diminuindo a energia necessária para essas transformações ocorrerem.
Em consideração à ação dos metais preciosos, podemos dizer que eles atuam como ____________ dessa reação.
a) Inibidores.
b) Venenos.
c) Modificadores.
d) Catalisadores biológicos.
e) Catalisadores.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!

