Hora de lembrar das aulas sobre Pressão, Temperatura e as Transformações Químicas nos gases. Veja no resumo a clássica Lei de Gay Lussac. Aproveite para o Enem.
Transformações isocóricas, isométricas ou isovolumétricas são aquelas em que o volume do gás permanece constante. Porém, ocorrem variações na pressão em relação às variações da temperatura.
- A palavra isocórica é de origem grega:
- ISSO (igual) + COROS (volume)
Charles e Gay-Lussac foram dois cientistas franceses que estudaram as transformações isocóricas, criando a Lei que leva seus nomes. Essa lei tem o seguinte enunciado: “Para uma massa fixa de gás, mantida a volume constante, a pressão exercida pelo gás é diretamente proporcional à temperatura absoluta”.
Essa lei tem o seguinte enunciado: “Para uma massa fixa de gás, mantida a volume constante, a pressão exercida pelo gás é diretamente proporcional à temperatura absoluta”.
Isso quer dizer que se aumentarmos a temperatura dentro de um recipiente (volume constante) a pressão também irá aumentar, e isso é conseqüência do aumento das colisões entre as moléculas do gás.
Esse enunciado pode ser expresso matematicamente como:
Ou, graficamente assim, com os vetores: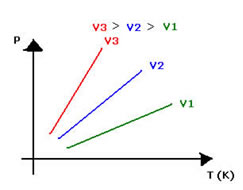 O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta.
O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta.
Quer saber mais sobre as transformações isocórica? Então assista a videoaula da professora Larissa, do Curso Enem Gratuito, e fique craque nesse assunto. Depois, continue revisando com a gente no post.
Onde você pode observar uma transformação isocórica?
Essa transformação pode ser vista, por exemplo, nos pneus de carros, motos e caminhões. Com um aumento de sua temperatura, a pressão dentro dos pneus aumenta. Por isso é necessário calibrar constantemente os pneus, ou seja, regular os níveis da pressão provocada pelos gases que os enchem. Isso garante seu melhor desempenho e também a segurança dos passageiros.
Entendeu? Então agora veja um exemplo:
(FUVEST – SP) Um recipiente indeformável, hermeticamente fechado, contém 10 litros de um gás perfeito a 30 ºC, suportando a pressão de 2 atmosferas. A temperatura do gás é aumentada até atingir 60º C.
a) Calcule a pressão final do gás.
b) Esboce o gráfico pressão versus temperatura da transformação descrita.
Solução da Letra a)
Considerando-se que o volume do gás é constante, temos que a transformação é isocórica. Assim, 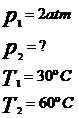
Substituindo os valores fornecidos pelo problema na equação da transformação isocórica, temos: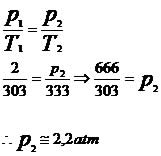
Assim, podemos concluir que a pressão e a temperatura são grandezas diretamente proporcionais.
Para fechar este resumo, veja uma aula complementar gratuita sobre As Leis Ponderais. A mais famosa de todas você conhece: Na natureza nada se cria, nada se perde. Tudo se tranforma. Confira:
Muito bom este resumo!
Agora um desafio para você! Não deixe de estudar!
(Mack-SP) Uma determinada massa fixa de gás contido em um balão encontra-se inicialmente em CNTP.
Em uma transformação isovolumétrica, sabendo-se que a pressão máxima interna permitida pelo balão é de 3,0 atm, se dobrarmos a temperatura absoluta inicial, a pressão final do gás e o efeito sobre o balão serão:
a) 2,0 atm e o balão não estoura
b) 2,0 atm e o balão estoura
c) 3,0 atm e o balão estoura
d) 1,5 atm e o balão não estoura
e) 1,0 atm e o balão não estoura
Resposta: A


