Veja a definição de Substâncias Simples e Substâncias Compostas. Tire todas as suas dúvidas sobre os Tipos de Misturas Químicas em mais uma aula que preparamos para você mandar bem no Enem.
Aprenda tudo sobre sistemas e misturas química, iniciand o aprendizado pelas substâncias puras ou espécies químicas.
- Começando pelo começo: Substância é toda matéria que possui propriedades químicas e físicas bem definidas. Agora, veja a diferença entre Substâncias Simples e Compostas:
- Substâncias puras simples – são formadas por átomos ou moléculas de um mesmo elemento químico. Ex.: Gás oxigênio (O2); gás hidrogênio (H2); diamante (C); gás ozônio (O3). Obs.: Muitos átomos são estáveis, o suficiente sozinhos e não formam moléculas. Ex.: Gás hélio (He).
- Substâncias puras compostas ou compostos químicos – são formados por átomos ou íons de dois ou mais elementos químicos diferentes. Ex.: água (H2O); dióxido de carbono (CO2), etc.
Dica 1 – Entenda tudo sobre Propriedades gerais da matéria nesta aula de Química Enem que preparamos para você – https://blogdoenem.com.br/propriedades-gerais-da-materia-quimica-enem/ 
As Misturas
- As Misturas são constituídas por duas ou mais substâncias com propriedades químicas e físicas diferentes.
- Ou seja, as misturas não possuem propriedades físicas e químicas definidas.
Mistura homogênea, sistema homogêneo ou solução – quando a mistura apresenta apenas uma fase visível a olho nu ou com auxílio de um microscópio óptico, ou seja, é monofásica.
- Exemplos:
- O ar atmosférico é constituído de aproximadamente 78% de gás nitrogênio (N2), 21% de gás oxigênio (O2) e 1% de outros gases.
- A mistura de açúcar (soluto) e água (solvente);
- OÁlcool hidratado 96%, que tem 4% de água.
- Nestes casos, são separadas por processos físicos mais complicados.
Mistura heterogênea ou sistema heterogêneo
As misturas são chamadas de Heterogêneas ou de Sistema Heterogênco quando podemos ver a olho nu ou com auxílio de um microscópio óptico as partículas formadoras da mistura.
- As misturas heterogêneas podem ser separadas por processos simples (mecânicos).
- Ex.: Mistura de água e óleo; leite (quando deixamos o leite azedar); sangue.
Entenda as Fases:
- Cada parte de uma mistura que pode ser distinguida a olho nu.
- Monofásico: sistema homogêneo.
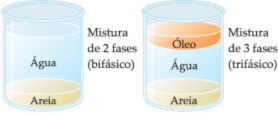
- Bifásico (duas fases): água e óleo.
- Trifásico (três fases): granito (pedra composta por três tipos de rocha). O granito é uma pedra cuja composição é feita por uma mistura heterogênea de quartzo, feldspato e mica, podemos ver pela diferença de cor de cada pedra.
- Polifásico (mais de três): óleo, areia, água e serragem, quando misturados podemos ver nitidamente a separação entre eles, pois não são miscíveis.

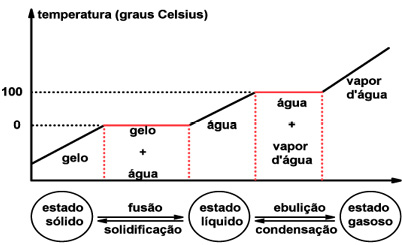
Comportamento de uma substância pura frente às mudanças de fases
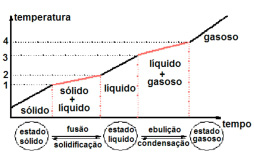
Comportamento de uma mistura homogênea frente às mudanças de fases.
Observação: Uma mistura heterogênea apresenta o comportamento de seus constituintes separadamente, logo, o gráfico de mudança de fase apresenta tantos pontos de fusão e ebulição quanto o número de constituintes.
Dica 2 – Preparado para o Exame Nacional do Ensino Médio? Estude sobre as Biomoléculas nesta aula de Química Enem que preparamos para você – https://blogdoenem.com.br/biomoleculas-quimica-enem/
Como não ocorre mistura efetiva dos constituintes nesse tipo de mistura, os constituintes comportam-se como se estivessem puros, sem interferir no comportamento dos outros.
Veja os Tipos especiais de Misturas:
Mistura eutética – Mistura especial de dois sólidos – durante a fusão, a temperatura é constante e, durante a ebulição, a temperatura é variável.
Um líquido com composição eutética solidifica-se e funde-se em uma única temperatura sem que os componentes da mistura se separem, ou seja, a composição da mistura permanece constante.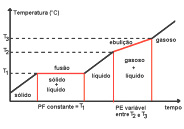
Mistura azeotrópica – Mistura especial de dois líquidos – durante a fusão, a temperatura é variável e, durante a ebulição, a temperatura permanece constante.
Numa mistura azeotrópica, a evaporação se dá sem modificação da composição da mistura.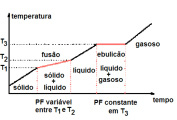
Alotropia
Quando um mesmo elemento químico produz diferentes compostos.
Ex.: Gás oxigênio (O2) e gás oxônio (O3).
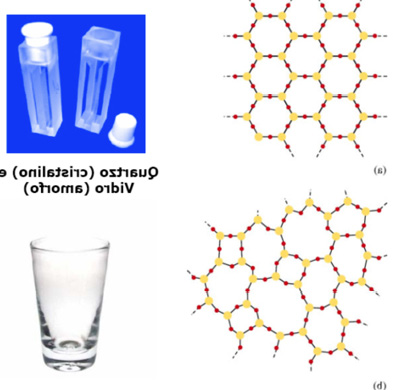
Quando os arranjos cristalinos dos compostos são diferentes.
Grafite (C) e diamante (C)
Enxofre rômbico e (S8(α)) e monoclínico (S8(β))
Fósforo vermelho (Pn) e branco (P4)
Quartzo (SiO4) e silicato (vidro comum) (SiO4)
Saiba mais sobre Substâncias Puras e Misturas nesta aula do cana Curso Enem Gratuito, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
Desafios
Questão 1
O bronze (utilizado para fabricação de medalhas olímpicas, dadas aos 3ºs colocados de cada competição), o “gelo seco” (CO2 usado para produção de fumaça artificial) e o diamante (usado em muitas joias preciosas) são, respectivamente, exemplos de:
a) mistura, substância simples e substância composta.
b) mistura, substância composta e substância simples.
c) substância composta, mistura e substância simples.
d) substância composta, substância simples e mistura.
e) substância simples, mistura e substância composta.
Dica 3 – Fique preparado para as provas do Enem e revise sobre as Funções Orgânicas em mais uma aula de Química Enem que preparamos para você – https://blogdoenem.com.br/funcoes-organicas-quimica-enem/
Questão 2
A camada de ozônio (O3), que protege a vida na Terra da incidência dos raios ultravioleta, é produzida na atmosfera superior pela ação de radiação solar de alta energia sobre moléculas de oxigênio (O2). Assinale a alternativa correta:
a) O ozônio e o oxigênio são alótropos.
b) O ozônio e o oxigênio são isótopos.
c) O ozônio e o oxigênio são isômeros.
d) O ozônio e o oxigênio são moléculas isoeletrônicas.
e) O ozônio e o oxigênio têm números atômicos diferentes.
Questão 3
Um cientista, a fim de verificar a pureza de uma substância sólida a qual acabou de sintetizar, submeteu uma fração da substância ao aquecimento e observou a variação de temperatura durante a fusão da substância. Esse princípio baseia-se no fato de que:
a) uma substância pura tem ponto de fusão constante e de ebulição variável.
b) uma substância pura tem ponto de fusão e de ebulição variáveis.
c) uma substância pura tem ponto de fusão e de ebulição constantes.
d) uma substância pura tem ponto de fusão que pode variar em até 1ºC devido às alterações nas condições de pressão do ambiente.
e) uma substância pura tem ponto de fusão variável e de ebulição constante.
Questão 4
Tanto o diamante como a grafita são formados apenas por átomos de carbono, entretanto, diferem bastante na maioria de suas propriedades. Isto é explicado pelo fato de apresentarem diferentes:
a) produtos de combustão.
b) estruturas cristalinas.
c) massas atômicas.
d) núcleos atômicos.
e) cargas elétricas.
Questão 5
Um dos mais conhecidos derivados do petróleo é a gasolina. Ela é encontrada nos postos de abastecimento de veículos e contém certo teor de álcool. Pode se determinar o volume de álcool na gasolina acrescentando água na mistura. Com relação à mistura citada, podemos afirmar que:
a) a água não se mistura com o álcool, por isso, forma uma única fase.
b) gasolina + álcool constituem uma mistura heterogênea.
c) gasolina + álcool + água formam uma mistura heterogênea de duas fases.
d) gasolina + álcool + água formam uma mistura heterogênea de três fases.
e) água + gasolina + álcool constituem uma mistura homogênea.
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!