A fórmula molecular indica o número de átomos de cada elemento que compõe uma molécula. Já a fórmula empírica indica a proporção entre os átomos de uma substância.
O que é fórmula molecular
A fórmula molecular nos indica o número de átomos de cada elemento que compõe a molécula ou espécie química da substância, bem como a proporção entre eles. Assim, por meio da análise da composição de uma fórmula molecular, podemos determinar quais elementos (análise qualitativa) que constituem a molécula e em qual proporção os átomos se encontram (análise quantitativa) na mesma.
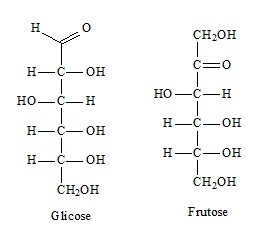
Por exemplo: a molécula do peróxido de hidrogênio é formada por dois átomos de hidrogênio e dois átomos de oxigênio. Portanto, a sua fórmula molecular é H2O2. Já a fórmula molecular da glicose é C6H12O6.
Veja mais três exemplos de fórmulas moleculares:
- Ácido acético: C2H4O2
- Ácido lático: C3H6O3
- Formaldeído: CH2O
Mas como é possível calcular a fórmula molecular de uma substância? Para a determinação da fórmula molecular é necessário primeiro obter a fórmula empírica dessa mesma substância.
Fórmula empírica
A fórmula empírica (ou mínima) indica a proporção, em menores números inteiros, entre os átomos que formam as substâncias.
Na glicose (C6H12O6), por exemplo, a proporção dos átomos é de um átomo de carbono, para dois de hidrogênio, para um de oxigênio, ou seja, CH2O (1:2:1).
É importante salientar que esse tipo de fórmula não é suficiente para identificar uma substância, pois há casos em que a fórmula mínima de uma substância corresponde à fórmula molecular de outra. Do mesmo modo, há substâncias que podem apresentar a mesma fórmula mínima. Veja no quadro abaixo:
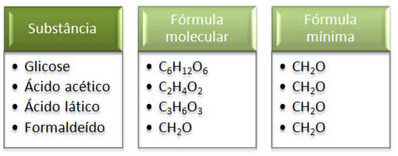
Veja que a fórmula mínima CH2O é a mesma para todas as substâncias. Isso porque ela expressa que, em todos os casos, os átomos de carbono, hidrogênio e oxigênio estão presentes nas fórmulas moleculares em uma relação de 1:2:1.
Além disso, o único que apresenta a fórmula molecular igual à fórmula empírica é o formaldeído.
Cálculo da fórmula empírica
Para determinar a fórmula empírica ou fórmula mínima, devemos seguir estes dois passos:
- Calcular o número de mol de átomos de cada elemento;
- Dividir os resultados pelo menor valor encontrado.
Veja um exemplo de como isso funciona na prática:
Uma amostra contém 2,4 g de carbono e 0,6 g de hidrogênio. A massa atômica do carbono é 12 e a do hidrogênio é 1. Para determinar a fórmula mínima do composto, devemos, inicialmente, calcular o número de mol (n) de átomos de cada elemento.
n = m/M
Para o carbono: 2,4 g / 12 g/mol = 0,2 mol
Para o Hidrogênio: 0,6 g/ 1 g/mol = 0,6 mol
Em seguida, determinamos as menores proporções possíveis em números inteiros. Como o menor valor encontrado foi 0,2, dividimos ambos os resultados por esse valor:
0,2 mol / 02 = 1
0,6 mol / 0,2 = 3
Assim, a fórmula mínima é CH3.
Achou difícil? Confira os quatro passos para você calcular a fórmula empírica de forma simples:

Como calcular a fórmula molecular
O cálculo da fórmula molecular pode ser feito de diversas maneiras, mas no post de hoje vamos apresentar duas delas.
1- A partir da porcentagem em massa, calculando a fórmula mínima.
Como exemplo, vamos utilizar uma amostra de 100 g de vitamina C ou ácido ascórbico (C6H8O6), cuja massa molecular é de 176.
C = 40,9% em massa = 40,9 g
H = 4,55 % em massa = 4,55 g
O = 54,6 % = 54,6 g
Em seguida, calculamos o número de mol de cada átomo:
C = 40,9 g / 12 g mol -1 = 3,41 mols
H = 4,55 g mol -1 / 1 g mol -1 = 4,55 mols
O = 54,6 g/ 16 g mol -1 = 3,41 mols
Agora que já encontramos o número de mols, iremos determinar a relação entre o número de mols. Dessa forma, iremos descobrir qual é a fórmula mínima:
C = 3,41 mols /3,41 = 1 mol
H = 4,55 mols / 3,41 = 1,33 mol
O = 3,41 mol / 3,41 = 1 mol
Como os valores encontrados não são inteiros, devemos, em seguida, multiplicá-los por um mesmo número que permita obter a menor proporção de números inteiros. Nesse caso, o número adequado é 3.
Assim:
C = 1 mol x 3 = 3 mol
H = 1,33 mol x 3 = 4 mol
O = 1 mol x 3 = 3 mol
Portanto, a fórmula mínima é: C3H4O3
Dessa maneira, podemos concluir que a relação entre a fórmula mínima e a molecular é:
Fórmula mínima Fórmula molecular
C3H4O3 ————————– (C3H4O3)n
MM= 88 ———————— MM = 176
Sendo assim:
88 n = 176
n = 2 → (C3H4O3)n → Fórmula molecular: C6H8O6
2- Relacionando as porcentagens em massa com a massa molecular do composto.
Vamos utilizar o mesmo exemplo da Vitamina C:
C = 40,9 %
H = 4,55 % → MM = 176
O = 54,6 %
Considerando que sua fórmula molecular seja: CxHyOz
Agora, devemos relacionar as porcentagens em massa com as massas atômicas e a massa molecular:
Cx + Hy + Oz
12 x + 1 y + 16 z = 176
↓ ↓ ↓ ↓
40,9 % 4,55 % 54,6 % = 100%
Cx → 176 ———100% Hy → 176 ———100% Oz → 176 ———100%
12 x ——- 40,9% 1 y ——— 4,55 % 16z ——–54,6 %
x = 6 y = 8 z = 6
Portanto, a fórmula molecular é C6H8O6.
Por fim, para entender ainda melhor como calcular a fórmula molecular, veja esta videoaula:
Exercício sobre fórmula molecular:
(PUCCamp-SP) Em 0,5 mol de quinina, substância utilizada no tratamento de malária, há 120 g de carbono, 12 g de hidrogênio, 1,0 mol de nitrogênio e 1,0 mol de átomos de oxigênio. Pode-se concluir que a fórmula molecular da quinina (massa molar = 324 g/mol) é:
a) C20H12N2O2
b) C20H24N2O2
c) C10H12NO
d) C10H6N2O2
e) C3H6NO
Resposta: B
Simulado de fórmula empírica e molecular
.