A constante de equilíbrio químico é um dos assuntos de química que aparece com bastante frequência nas provas do Enem e dos vestibulares. E para você se dar bem nessas provas, o Blog do Enem preparou um super-resumo para você! Vamos estudar?
A constante de equilíbrio é um valor que relaciona as concentrações das espécies reagentes e do produto no momento em que ocorre o equilíbrio.
Dica 1 – Saiba mais sobre equilíbrio químico acessando o nosso Blog do Enem e conferindo um super-resumo que preparamos especialmente para você! Não deixe de conferir!
O Kc representa o valor das constantes de equilíbrio em uma temperatura determinada , em função da concentração da espécies em mol L -1 ou [ ] mol L-1 .
Em caso da ocorrência da reação em fase gasosa, a constante é comumente expressa Kp, em função das pressões parciais das espécies presentes no equilíbrio.
Resumo sobre Constante de Equilíbrio
Veja coma professora de Química Larissa Campos, do canal do Curso Enem Gratuito, uma introdução bem simples e rápida para você aprender a resolver questões de Constante de Equilíbrio Químico.
Observe a reação genérica abaixo:
![]()
A constante de equilíbrio é dada por:

Note:
Cada concentração, na expressão da constante de equilíbrio, é elevada a um expoente correspondente ao coeficiente da respectiva substância na reação. E outro detalhe muito importante! O Kc não apresenta nenhuma unidade.
O que é o Equilíbrio Químico?
Confira com o professor de química Felipe Sobis as dicas básicas para você gabaritar Equilíbrio Químico nas provas:
Veja o exemplo da formação do trióxido de enxofre (SO3) a partir do gás oxigênio (O2) e do dióxido de enxofre (SO2(g)) que é uma etapa do processo de fabricação do ácido sulfúrico:
A constante de equilíbrio desta reação é dada por:
Equilíbrio
2SO2(g) + O2(g) ⇌ 2SO3(g)
2SO3(g) ⇌ 2SO2(g) + O2(g)
Constante de equilíbrio
[SO3]2
Kc = _____________
[SO2]2. [O2]1
[SO2]2. [O2]1
Kc = _____________
[SO3 ]2
Um aspecto muito importante na expressão da constante de equilíbrio, é que não devem ser representados componentes sólidos e nem líquidos puros, pois somente as matérias que podem sofrer variação é que participam da expressão.
Entendeu? Então observe esse exemplo:
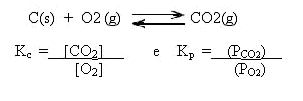
Veja que o C(s) não entra na expressão da constante de equilíbrio!
Dica 1 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares. Veja um super- resumo preparado pela professora Munique Dias sobre outros detalhe do Equilíbrio Químico. Vai ficar de fora dessa?
Os valores de Kc podem nos mostrar se a concentração dos reagentes e dos produtos são iguais ou se uma é maior do que a outra. Preste atenção:
- Se Kc ou Kp for igual a um (Kc = 1), isso significa que a concentração dos reagentes e produtos são iguais.
- Se Kc ou Kp for alto, isso significa que os produtos estão em maior concentração pois na expressão do Kc os produtos estão no numerador.
- Se Kc ou Kp for baixo, isso significa que os reagentes estão em maior concentração, pois na expressão de Kc os reagentes estão no denominador.
Continue estudando!
Com o Curso Enem Gratuito você se prepara para o Enem e para os vestibulares. Assista essa aula da professora Larissa Campos com exercícios resolvidos de equilíbrio químico.


