Vamos relembrar um pouquinho sobre o número de Avogadro? O blog do Enem preparou um super-resumo para você! Estude com a gente.
Eis a Lei de Avogadro…
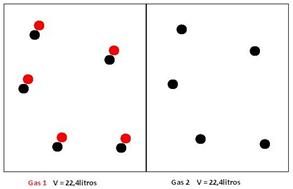
Volumes iguais, de quaisquer gases, nas mesmas condições de pressão e temperatura, apresentam a mesma quantidade de substâncias em mol (moléculas).
Dica 1 – O que mais cai em Química nos Vestibulares e no Enem? Veja aqui as melhores dicas: https://blogdoenem.com.br/enem-2013-quimica-cai-mais/
Amedeo Avogadro (1776 – 1856) foi um importante químico e físico italiano. Nasceu em Turim, a 9 de agosto de 1776, e aí faleceu a 9 de julho de 1856. Formou-se em ciências jurídicas, mas apesar de haver praticado a advocacia por alguns anos, Avogadro era bastante interessado pela ciência, especialmente a Química.
A importância dos trabalhos de Avogadro no ramo científico ficou manifestada na Lei de Avogadro, que tratava da quantidade de matéria em gases a diferentes temperaturas. Seria uma forma de expressar uma lei de conservação.
Vamos relembrar o conceito de volume molar?
É o volume ocupado por um mol de qualquer gás, a uma determinada pressão e temperatura.
Volume molar = 22,4 L/mol
Onde a relação entre o volume e o número de mol é constante:
V/n=K
* 22,4 litros de qualquer gás possuem 6,02 x 1023 moléculas.
O volume 22,4 litros é praticamente o mesmo para qualquer gás, isso se explica pelo fato de que o tamanho de uma molécula gasosa é desprezível se comparado com o espaço vazio que há entre elas.
Atenção!
Esse valor é resultado de experimentos feitos em Condições Normais de Temperatura e Pressão (CNTP) – 1 atm e 0 °C.
Dica 2 – Relembre as principais unidades de medidas mais utilizadas nas questões de química dos vestibulares de todo Brasil e no Enem. Acesse o nosso link e veja tudo sobre as unidades e suas conversões. Aproveite essa oportunidade! https://blogdoenem.com.br/unidades-de-medidas-quimica/
A hipótese de Avogadro de que volumes iguais de gases diferentes, nas mesmas condições de pressão e temperatura, contêm o mesmo número de partículas levou à determinação da constante de Avogadro.
A constante estabelecida por Avogadro e posteriormente verificada experimentalmente por vários cientistas é conhecida atualmente como o Número de Avogadro.
O Número de Avogadro ( Na) representa o número de partículas ou moléculas contidas num mol.
Na=6,023×1023 moléculas
O mol representa a grandeza da quantidade de matéria e a massa contida em 1 mol é chamada de massa molar (M). Para calcular o número de mols contidos em uma determinada massa m de um gás, usa-se a relação:
Saiba mais sobre o número de Avogadro assistindo a uma super vídeoaula da Khan Academy traduzida para Português pela Fundação Lemann. Não deixe de conferir!
O volume de 22,4 litros, aproximadamente, contém 6,022×1023 moléculas de qualquer gás. Isto porque o espaço vazio entre as moléculas é muito maior que o tamanho das respectivas moléculas. Logo, uma variação no tamanho das moléculas acarretará uma variação desprezível no volume do gás, à uma temperatura ambiente, em torno de 300K e pressão de 1atm, que corresponde a 1,01x105Pa. Ou seja, o volume ocupado por qualquer gás nestas condições é aproximadamente igual:
Dica 3 – Reveja também outro assunto de química que cai bastante nas provas dos vestibulares e do Enem que é Biodiesel. Acesse o nosso blog do Enem e veja um super resumo preparado pela professora Munique Dias. Vai ficar de fora dessa? https://blogdoenem.com.br/quimica-biodiesel-combustivel/
Que tal um desafio para você? Vamos nessa?
4,0 mols de oxigênio estão num balão de gás. Há um vazamento e escapam 8,0 x 1012 moléculas de oxigênio. Considerando que o número de Avogadro é 6,02 x 1023, a ordem de grandeza do número de moléculas que restam no balão é:
a) 1010 b) 1011 c) 1012 d) 1024 e) 1025
Resposta: D
Dica 4 – Relembre outros assuntos de química acessando o nosso blog www.blogdoenem.com.br e gabarite as questões de química nas provas dos vestibulares e do Enem.


