Veja Ligações Químicas Metálicas e Não Metálicas, e confira o que são as Ligações Covalentes; Polares e Apolares para mandar bem nos desfios do próximo Enem.
Você lembra das aulas que teve no Ensino Médio sobre as Ligações Químicas? Lembra das Ligações Iônicas, e das Covalentes? Não, então é hora revisar, pois as Ligações são tema frequentes para o Enem e os vestibulares. Confira!
Ligações químicas intramoleculares: Poucos elementos encontram-se naturalmente no estado atômico, geralmente os átomos dos elementos se ligam entre si.
Teoria dos octetos: Os átomos interagem entre si para obter configuração eletônica de gás nobre (com dois (no caso do H e do K, s2) ou oito elétrons na camada de valência, s2p6).
A Classificação das ligações químicas
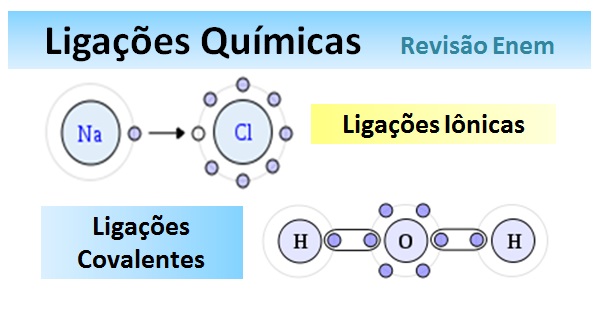
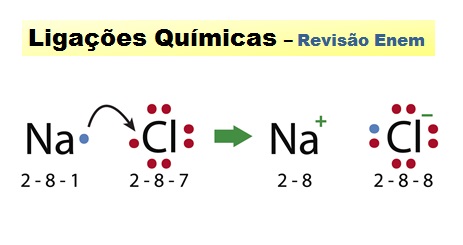
1 – Ligações iônicas – ocorrem entre metale ametal ou metal e hidrogênio.
• A ligação ocorre através da formação de íons, onde um elemento muito eletropositivo transfere elétrons para um muito eletronegativo.
• A estabilização do composto ocorre pela formação de um reticulo cristalino (através de atração eletrostática (carga negativa/carga positiva).
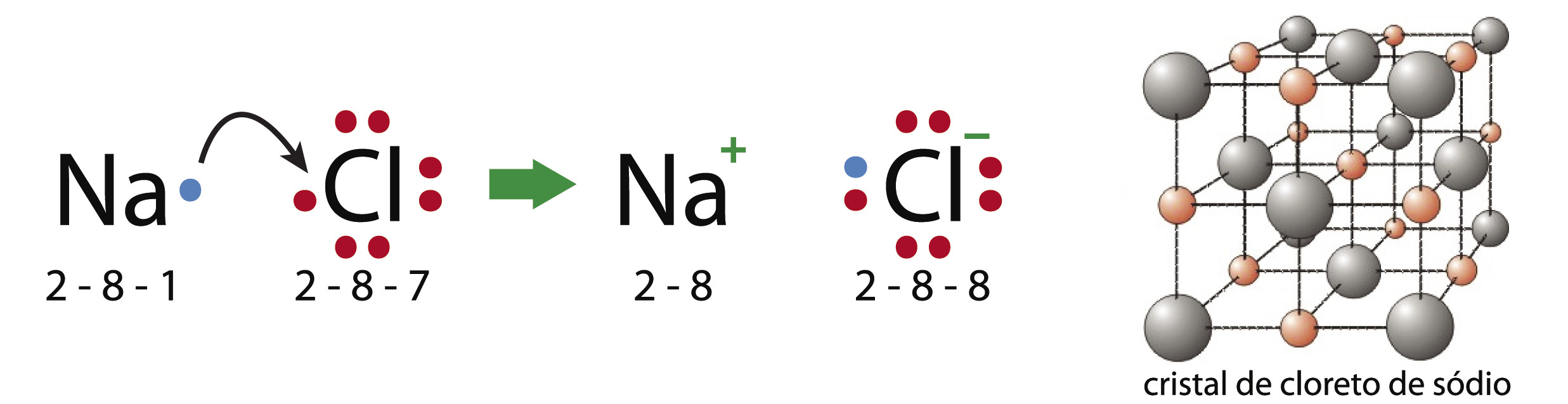
Formação do cloreto de sódio (sal de cozinha)
Dica 1 – Para gabaritar em Química Enem, entenda como relacionar as propriedades químicas e físicas dos elementos dentro da Tabela Periódica. Confira Tabela Periódica aqui.
Resumo sobre Ligações Químicas
Hora de recuperar o conteúdo sobre as Ligações Iônicas e as Ligações Covalentes. Confira com o professor Sobis:
Muito show este resumo. E tem mais pra você no canal Curso Enem Gratuto. Vamos prosseguir:
Propriedades dos compostos iônicos:
• São sólidos nas condições ambiente;
• Apresentam altos pontos de fusão e ebulição;
• São condutores de eletricidade quando no estado liquido (fundidos) ou quando dissolvidos em água;
• A maioria dos compostos é solúvel em água.
Determinação da fórmula de um composto iônico
A+X B-Y→ AYBX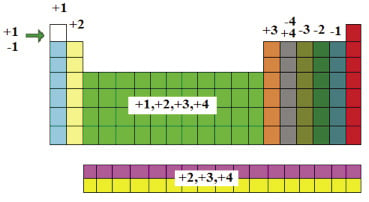 Veja na tabela períodica as Principais valências dos elementos
Veja na tabela períodica as Principais valências dos elementos
Exemplos:
• NaCl – cloreto de sódio (sal de cozinha);
• CaCO3 – carbonato de cálcio (calcário) – responsável pela dureza temporária da água;
• BaSO4 – sulfato de bário – usado como contraste em exames de raio-X do estomago;
• MgCl2 – cloreto de magnésio;
• NaH – hidreto de sódio
Dica 2 – Metais alcalinos, calcogênios, halogênios e gases nobres. Revise nesta aula de Química Enem, como é fácil localizar aqui os elementos químicos na Tabela Periódica.
2 – Ligações covalentes
- São aquelas que ocorrem entre ametal e ametal ou ametal e hidrogênio. São “Covalentes”.
- A ligação ocorre através do compartilhamento de um par de elétrons entre elementos, não metálicos, com eletronegatividades próximas.
- Ligações covalentes coordenadas (dativas) – ocorre compartilhamento de elétrons um átomo, já estável (octeto completo), compartilha um par de elétrons com outro átomo eletrodeficiente.
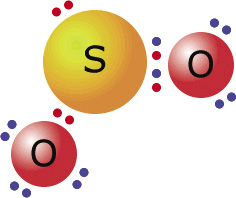 Dióxido de enxofre (um dos responsáveis pela chuva ácida)
Dióxido de enxofre (um dos responsáveis pela chuva ácida)
Ligações Químicas Polares e Apolares
Hora de ver um resumo simples e rápido para você fixar bem este conteúdo. Veja com o professor Dimas:
Bora prosseguir!
Ligações covalentes polares. (momento dipolo – μ≠0)
• Para moléculas diatômicas- ocorrem entre dois átomos com diferentes eletronegatividade.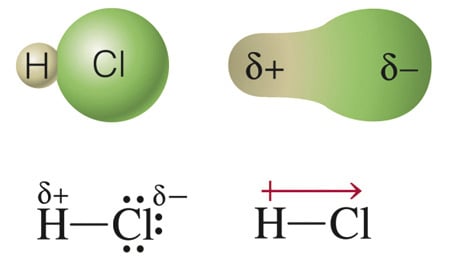 Ácido clorídrico (HCl)
Ácido clorídrico (HCl)
Ligações covalentes apolares
- Elas tem o momento dipolo nulo – μ=0
- As ligações apolares ocorrem entre dois átomos com a mesma eletronegatividade.
- Exemplos de ligações covalents apolares
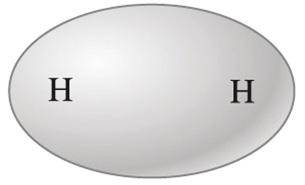
- x. H2, F2, O2, N2
 Molécula de H2
Molécula de H2
OBS: a ligação C–H é considerada apolar, pois tem um baixo momento de dipolo.
Dica 3 – Para gabaritar em Química no próximo Enem, relembre aqui os modelos atômicos e as partículas fundamentais, como o Átomo.
Propriedades dos compostos covalentes:
• São sólidos, líquidos ou gasosos nas CNTP;
• Apresentam baixos pontos de fusão e ebulição (comparados aos iônicos);
• São maus condutores de eletricidade, alguns podem conduzir quando em meio aquoso (ionização).
• A maioria dos compostos é solúvel em solventes orgânicos.
Exemplos
• H2SO4 –ácido sulfúrico (ácido de bateria de carros);
• HClO – hipoclorito de sódio (alvejantes clorados)
• F2 – Flúor
• H20 – água
Ligações metálicas
- As Ligações Químicas metálicas ocorrem, como o próprio nome indica, entre metais.
- Os elétrons ficam livres em torno de cátions e átomos neutros no retículo (“mar de elétrons”).
 Reticulo cristalino
Reticulo cristalino
Propriedades dos compostos metálicos
• São sólidos nas condições ambientes (Exceção Hg);
• Possuem Brilho (Efeito fotoelétrico);
• Possuem altos P.F. e P.E.
• Conduzem corrente elétrica no estado sólido ou fundidos (elétrons livres);
• São Dúcteis (fazer fios) e Maleáveis (fazer lâminas).
Principais ligas metálicas
• Ouro 18 quilates: (Au e Cu);
• Aço: (Fe e C);
• Bronze: (Cu e Sn);
• Latão: (Cu e Zn)
• Amálgama de Prata: (Hg e Ag)
• Liga leve: (Mg e Al)
• Solda: (Pb e Sn)
Desafios
Questão 01
A pólvora, uma invenção revolucionária, descoberta em 1044, teve grande impacto nas civilizações. Uma reação que pode representar a explosão da pólvora provocada por ignição é.
2NaNO3(s) + S(s) + 3C(s) → Na2S(s) + N2(g) + 3CO2(g)
É correto afirmar:
a) o nitrato de sódio é um composto estabilizado por ligações metálicas.
b) o sulfeto de sódio (Na2S) apresenta ligações covalentes ente os átomos de sódio e enxofre.
c) o monóxido de carbono (CO) é uma molécula que apresenta ligações covalentes polares ente seus átomos.
d) o gás nitrogênio (N2) é um composto iônico.
e) o Na2S é uma molécula covalente polar.
Questão 02
A formação de ácido nítrico (HNO3) na atmosfera, durante a noite, ocorre segundo a reação:
2NO2 + O3 + H2O → 2HNO3 + O2
É incorreto afirmar:
a) o ozônio (O3) apresenta ligações covalentes polares em suas estruturas.
b) na molécula de água existem duas ligações covalentes polares.
c) o ácido nítrico é apresenta apenas ligações covalentes e covalentes dativas.
d) o gás oxigênio apresenta ligações covalentes apolares.
e) o ozônio (O3) apresenta ligações covalentes apolares em suas estruturas.
Questão 03
(ENEM – 2009 adaptado) Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante os processos de lavagem, a remoção de substâncias de baixa solubilidade em água, por exemplo, óleos e gorduras.
A figura a seguir representa a estrutura de uma molécula de sabão.Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
CH3(CH2)16COO- + H2O → CH3(CH2)16COOH + HO-
Em relação aos compostos e moléculas citados é correto afirmar:
- a) o sabão apresenta ligação covalente entre o átomo de oxigênio e o átomo de sódio.
- b) o ácido carboxílico mostrado apresenta ligações covalentes polares entre o átomo de carbono e o átomo de oxigênio.
- c) todos os compostos mostrados só apresentam ligações covalentes.
- d) o sabão apresenta ligações metálicas em sua estrutura.
- e) a molécula de água apresenta ligações covalentes dativas em sua estrutura.
Questão 04
Os átomos da molécula de CO2 estão unidos por
- a) duas ligações covalentes polares duplas
- b) duas ligações covalentes coordenadas dativas
- c) quatro ligações covalentes polares duplas
- d) quatro ligações covalentes polares duplas
- e) quatro ligações covalentes apolares duplas
Questão 05
Comparando os sistemas abaixo, qual conduz melhora corrente elétrica?
- a) água sólida
- b) água líquida
- c) gelo seco (CO2)
- d) cloreto de sódio sólido
- e) cloreto de sódio fundido
Você consegue resolver estes exercícios? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para cada questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
 Molécula de H
Molécula de H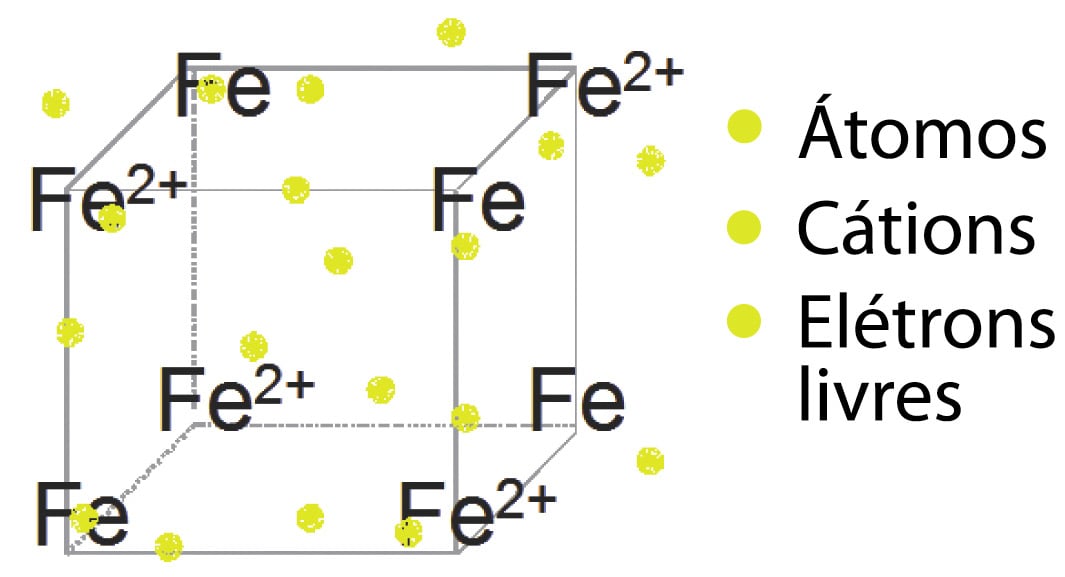 Reticulo cristalino
Reticulo cristalino