Esta você já sabe: Quanto maior a Temperatura, mais agitadas ficam as moléculas de um gás dentro de um recipiente com Volume definido, resultando em maior Pressão, e vice-versa. Mas, não custa nada ver o resumo sobre as variáveis que interferem nos estados dos gases. Cai direto no Enem, no Encceja e nos vestibulares. Vem!
Para o estudo dos gases, é importante conhecer três grandezas físicas que são: Pressão, Volume e Temperatura – as variáveis de estado de um gás. Com certeza você lembra das aulas sobre as CNTPs: as Condições Normais de Temperatura e Pressão. Não lembra? Bora ver o resumo aqui.
A pressão, o volume e a temperatura são chamadas de variáveis de estado dos gases porque elas influenciam nas propriedades e comportamento dos mesmos. Um botijão de gás de cozinha, desses de aço que se utilizam na maioria das casa no país, ou aqueles cilindros maiores, que se utilizam em prédios com gás encanado, são um excelente exemplo para você aprender.
Ali dentro dos botijões ou dos cilindos o gás está sob forte pressão, e fica no esta do líquido. Quando ele “vaza” para o ambiente, ou quando segue pelo encanamento até os fogões, ele perde a condição de “sob pressão” e muda do estado líquido para gasoso.
Resumo sobre as Propriedades dos Gases
Confira agora com o professor Felipe Sobis, do canal de vídeos do Curso Enem Gratuito, uma aula-resumo sobre como os gases se comportam diante da variáveis de Pressão, Temperatura, e Volume. É a introdução perfeita para você dominar em seguida o conteúdo de mudanças de estado dos gases.
As dicas do professor Sobis:
- Os gases apresentam forma e volume variável, adquirindo a forma do recipiente que o contém.
- As partículas que compõem os gases se encontram muito afastadas uma das outras e em constante movimento, podendo ser comprimidas e se expandir.
- Podemos observar essas duas características dos gases, quando aumentamos a temperatura e/ou diminuímos a sua pressão, nesse momento o gás irá se expandir.
- Ao contrário, se diminuímos a temperatura e/ou aumentamos a sua pressão, ele será comprimido dentro do recipiente.
- As moléculas gasosas apresentam a propriedade de se espalharem em um certo ambiente.
- Ou seja, misturam-se com outros gases, em um processo denominado de difusão.
Confira as CNTPs
Vamos relembrar cada uma dessas grandezas? 
Pressão
A pressão de um gás corresponde a força média por unidade de área com que as partículas desse gás colidem com as paredes do recipiente em que se encontram.
Assim, quando diminuímos o volume ocupado por um gás, a colisão entre as suas partículas aumentam, aumentando consequentemente a pressão exercida por esse gás.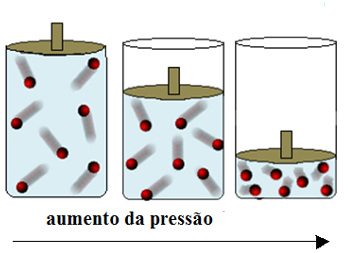 Veja na imagem: Quanto maior a pressão, menor o volume resultante (e maiores as colisões internas). A fonte da imagem é o portal Mundo Educação. A pressão de um gás corresponde a força média por unidade de área com que as partículas desse gás colidem com as paredes do recipiente em que se encontram.
Veja na imagem: Quanto maior a pressão, menor o volume resultante (e maiores as colisões internas). A fonte da imagem é o portal Mundo Educação. A pressão de um gás corresponde a força média por unidade de área com que as partículas desse gás colidem com as paredes do recipiente em que se encontram.
Assim, quando diminuímos o volume ocupado por um gás, a colisão entre as suas partículas aumentam, aumentando consequentemente a pressão exercida por esse gás.
Veja na imagem acima o que acontece quando você utiliza um pistão ou embolo para reduzir o volume disponível para um gás: Quanto maior a pressão, menor o volume resultante (e maiores as colisões internas).
Torricelli e a Presão Atmosférica
A primeira pressão de um gás a ser determinada experimentalmente foi a pressão do ar atmosférico, que, na verdade, é uma mistura de gases. Evangelista Torricelli foi o primeiro cientista a medir a pressão atmosférica, em 1643.
Torricelli (na imagem) desenvolveu um equipamento para medir a pressão. Ele preencheu um tubo com mercúrio e o inverteu sobre um recipiente que também continha mercúrio. Torricelli observou que o mercúrio não escoava completamente e que havia um espaço vazio na parte superior da coluna (vácuo).
Torricelli observou que o mercúrio não escoava completamente e que havia um espaço vazio na parte superior da coluna (vácuo).
O mercúrio descia até uma altura de 760 mm, ao nível do mar. Essa altura é proporcional à pressão exercida pelo ar. Assim, a pressão exercida pelo ar. Assim, a pressão de 1 atmosfera equivale a 760 mmHg.
Veja na imagem da Universidade Federal do Ceará uma representação para você entender o experimento de Torricelli: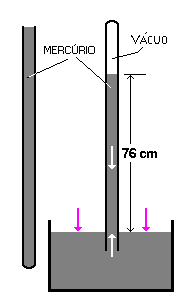 O sistema internacional de Medidas (SI) determina que as pressões sejam indicadas pela unidade Pascal (Pa), definida como pressão exercida por uma força de 1 newton aplicada numa área de 1m2. No entanto, o SI aceita o bar como unidade de pressão em uso.
O sistema internacional de Medidas (SI) determina que as pressões sejam indicadas pela unidade Pascal (Pa), definida como pressão exercida por uma força de 1 newton aplicada numa área de 1m2. No entanto, o SI aceita o bar como unidade de pressão em uso.
Volume
Corresponde ao espaço ocupado pelo gás. O volume do gás pode variar em função do recipiente que o contêm. No sistema internacional de unidade (SI), usa-se metro cúbico (m3) para medir o volume de um gás, mas o litro (L) também é bastante utilizado.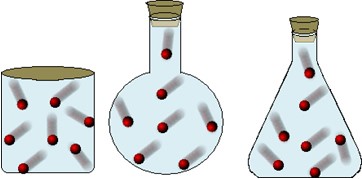 Volume ocupado pelos gases em diferentes recipientes – Fonte: http://manualdaquimica.uol.com.br
Volume ocupado pelos gases em diferentes recipientes – Fonte: http://manualdaquimica.uol.com.br
Temperatura
Está diretamente relacionada á agitação das moléculas do gás. Quanto maior a velocidade delas, maior a temperatura. A unidade no sistema internacional (SI) é o Kelvin (k), também chamada de escala absoluta. 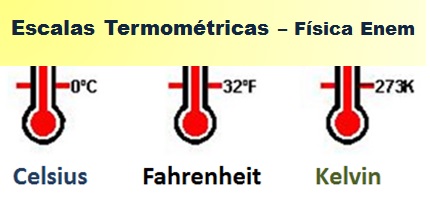 Outras unidades usuais são a escala Celsius (°C) e a escala Fahrenheit (°F).
Outras unidades usuais são a escala Celsius (°C) e a escala Fahrenheit (°F).
A mudança de estado dos gases
Veja com o professor Marcelo, do canal do Curso Enem Gratuito, um resumo vem rápido para você dominar a mudança de estado dos gases, e as variáveis que interferem neste processo.
Valeu pra você o resumo do professor Marcelo? Agora é hora de testar seus conhecimentos
Exercícios sobre a Mudança de Estado dos Gases
(UFU-MG) As grandezas que definem completamente o estado de um gás são:
a) somente pressão e volume
b) apenas o volume e a temperatura.
c) massa e volume.
d) temperatura, pressão e volume.
e) massa, pressão, volume e temperatura.
Resposta: d
Curso Enem Gratuito
Quer aumentar suas chances no próximo Exame Nacional do Ensino Médio e mandar bem nas Notas de Corte do Enem? Estude com as apostilas e aulas gratuitas do Curso Enem Online.
Todas as matérias do Exame e ainda as Dicas de Redação. Acesse aqui o Curso Enem Gratuito.
Os textos e exemplos de apresentação desta aula sobre a mudança de estado dos gases foram preparados pela professora Munique Dias para o Blog do Enem.  Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .
Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias .

