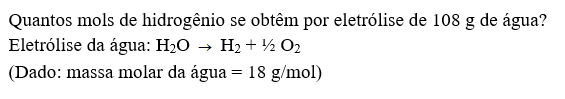É muito fácil para você acertar as questões de Oxidação e de Redução dentro da Eletroquímica. Elas fazem a transformação de energia química em energia elétrica, ou vice-versa. Com os exercícios sobre eletroquímica você testa seus conhecimentos e se prepara para a prova. São 10 questões para você estudar e uma super videoaula para revisar o conteúdo!
Para se dar bem nas questões de Química no Enem não tem segredo: tem que estudar! Para te ajudar nessa jornada, preparamos uma lista de exercícios sobre eletroquímica para você testar o que sabe. Mas antes veja o resumo sobre o tema para já começar gabaritando até no simulado!
Resumo sobre eletroquímica
A eletroquímica estuda a transformação (conversão) de energia química em elétrica e vice-versa. Os principais fenômenos envolvidos são a produção de corrente elétrica através de uma reação química de pilha e a ocorrência de uma reação química pela passagem de corrente elétrica (eletrólise).
Ou seja, na pilha ocorre uma reação espontânea de tipo redox que resulta numa quantidade de eletricidade. Enquanto isso, a eletrólise é um processo de reação induzida onde se converte energia elétrica em energia química.
Reações de Oxidação e Redução
Veja com a professora de química Larissa Campos, do canal do Curso Enem Gratuito, um resumo rápido para você dominar reações de Oxidação e de Redução dentro da Eletroquímica:
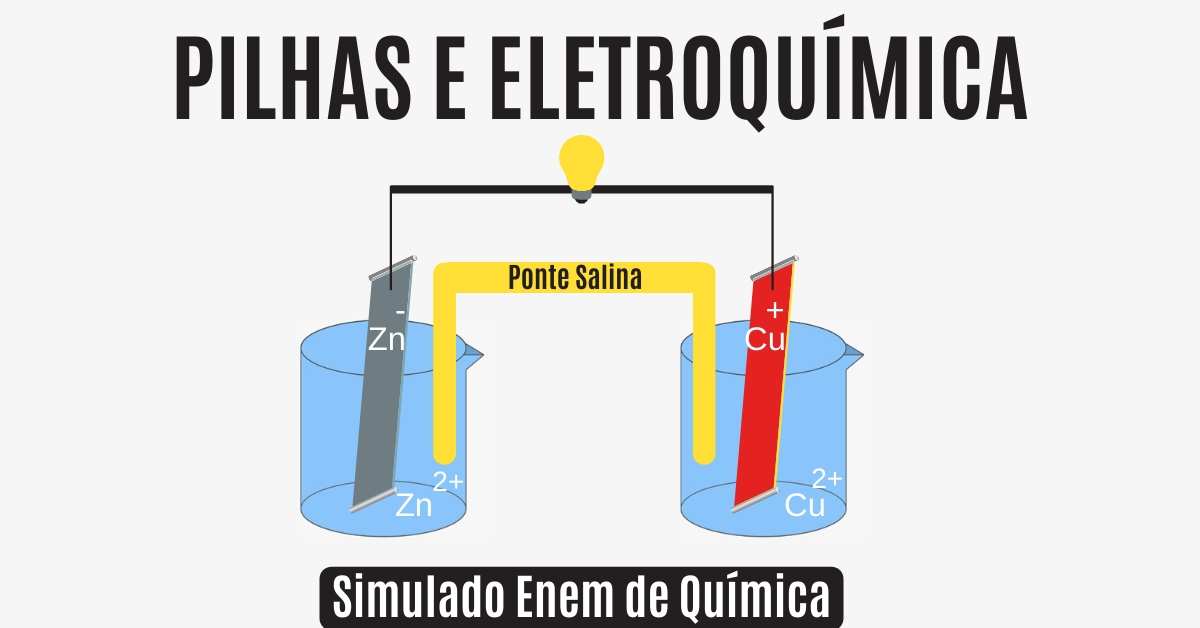
Pilhas
As pilhas são dispositivos que aproveitam a transferência de elétrons de uma reação de oxirredução e que propiciam o aparecimento de uma corrente elétrica através de um condutor.
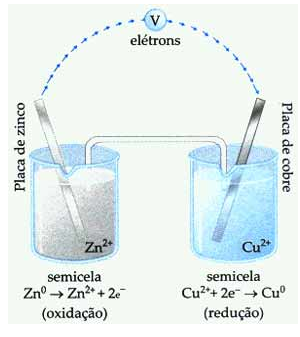
No caso das pilhas tradicionais, os processos de oxidação (perda de elétrons) e de redução (ganho de elétrons) acontecem da seguinte maneira:
- Oxidação = perder elétrons = agente redutor = Zn0 → Zn2+ + 2e-
- Redução = ganhar elétrons = agente oxidante = Cu2 + 2e- → Cu0
Observe na imagem abaixo uma Pilha de Daniell. Perceba que o sentido da movimentação dos elétrons é do eletrodo de zinco para o eletrodo de cobre. Com o passar do tempo, a lâmina de zinco vai sofrendo corrosão enquanto a massa da lâmina de cobre vai aumentando.
Consequentemente, a solução do eletrodo de zinco fica cada vez mais concentrada, enquanto no eletrodo de cobre a solução fica mais diluída.
Videoaula sobre eletroquímica
Saiba mais sobre os processos de oxidação e redução com a videoaula do professor Sobis para, em seguida, resolver os exercícios sobre eletroquímica:
Para você não esquecer como funciona os processos de oxidação e redução, confira a paródia do prof. Sobis que está logo depois dos exercícios!
Exercícios sobre eletroquímica
Agora sim! Responda às 10 questões do simulado Enem de Química e garanta o sucesso na hora da prova!
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(FUVEST SP/2018)
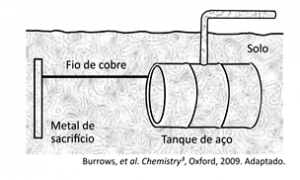
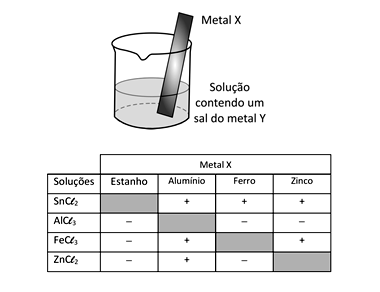
Um método largamente aplicado para evitar a corrosão em estruturas de aço enterradas no solo, como tanques e dutos, é a proteção catódica com um metal de sacrifício. Esse método consiste em conectar a estrutura a ser protegida, por meio de um fio condutor, a uma barra de um metal diferente e mais facilmente oxidável, que, com o passar do tempo, vai sendo corroído até que seja necessária sua substituição.

Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo (+) indica que foi observada uma reação química e o (–) indica que não se observou qualquer reação química.

Note e adote: o aço é uma liga metálica majoritariamente formada pelo elemento ferro.
Da análise desses resultados, conclui-se que pode(m) ser utilizado(s) como metal(is) de sacrifício para tanques de aço:
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 2 de 10
2. Pergunta
(FCM PB/2017)
Uma grande porcentagem da poluição vem dos veículos que liberam poluentes atmosféricos, como monóxido de carbono, dióxido de azoto, partículas ultrafinas e compostos orgânicos voláteis, que podem ter efeitos negativos, não apenas sobre o meio ambiente, mas também sobre a saúde humana. A melhor forma de solucionar este problema é substituindo a queima de combustível fóssil por um combustível mais limpo. O hidrogênio é um excelente substituto, pois ele é facilmente produzido com água e tem um excelente aproveitamento. Uma boa forma de produzir hidrogênio é através da eletrólise. Este método é bem interessante e relativamente simples: é realizada utilizando-se a energia elétrica e água, aplica-se uma tensão maior que 1,23 volts para quebrar a molécula de água (H2O) em seus constituintes, o hidrogênio (H2) e o oxigênio (O2).
 Correto
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 3 de 10
3. Pergunta
(IME RJ/2017)
Uma empresa de galvanoplastia produz peças especiais recobertas com zinco. Sabendo que cada peça recebe 7 g de Zn, que é utilizada uma corrente elétrica de 0,7 A e que a massa molar do zinco é igual a 65 g/mol, qual o tempo necessário para o recobrimento dessa peça especial?
(Constante de Faraday: 1 F = 96500 C.mol−1)
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 4 de 10
4. Pergunta
(Mackenzie SP/2017)
Um estudante de química colocou, separadamente, barras de chumbo, níquel, ferro e cobre no interior de 4 béqueres, que continham solução aquosa de nitrato de estanho II de concentração 1 mol.L–1 a 25 ºC. As quatro possíveis reações de oxirredução, que ocorreriam espontaneamente, nos béqueres I, II, III e IV foram escritas abaixo:
 Correto
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 5 de 10
5. Pergunta
(Mackenzie SP/2017)
Um dos modos de se produzirem gás hidrogênio e gás oxigênio em laboratório é promover a eletrólise (decomposição pela ação da corrente elétrica) da água, na presença de sulfato de sódio ou ácido sulfúrico. Nesse processo, usando para tal um recipiente fechado, migram para o cátodo (polo negativo) e ânodo (polo positivo), respectivamente, H2 e O2. Considerando-se que as quantidades de ambos os gases são totalmente recolhidas em recipientes adequados, sob mesmas condições de temperatura e pressão, é correto afirmar que
Dados: massas molares (g·mol–1) H = 1 e O = 16
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 6 de 10
6. Pergunta
(ACAFE SC/2017)
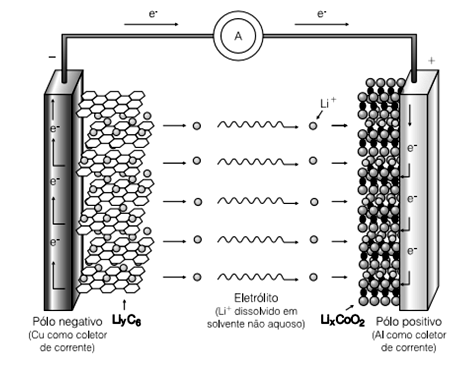
Recentemente uma grande fabricante de produtos eletrônicos anunciou o recall de um de seus produtos, pois estes apresentavam problemas em suas baterias do tipo íons lítio.
Considere a ilustração esquemática dos processos eletroquímicos que ocorrem nas baterias de íons lítio retirada do artigo “Pilhas e Baterias Funcionamento e Impacto Ambiental”, da revista Química Nova na Escola, número 11, 2000, página 8.

 Correto
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 7 de 10
7. Pergunta
(Fac. Direito de São Bernardo do Campo SP/2017)
Quatro metais designados por D, G, X e Z foram analisados quanto à sua reatividade. Foi observado que apenas os metais G e Z reagem com solução aquosa de ácido clorídrico de concentração 0,1 mol.L–1 formando gás hidrogênio. O metal G não reage com solução contendo cátions Zn+ . O metal X não reage com nenhuma das soluções dos cátions dos outros metais.
A afirmativa que apresenta corretamente os metais em ordem crescente de caráter redutor é
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 8 de 10
8. Pergunta
(UNITAU SP/2017)
Quando uma corrente de 0,5 A e 12 volts passa por 5 minutos no resistor imerso na água, 0,901 g de água, que está na temperatura de 100 ºC, sob uma pressão de 1 atmosfera, transforma-se em vapor. O aumento na entalpia por mol de água (kJ/mol) no ponto de ebulição é
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 9 de 10
9. Pergunta
(ENEM/2014)
A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)23–. Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.

BENDASSOLLI, J. A. et al. Procedimentos para a recuperação de Ag de resíduos líquidos e sólidos. Química Nova, v. 26, n. 4, 2003 (adaptado). Das espécies apresentadas, a adequada para essa recuperação é
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!
-
Pergunta 10 de 10
10. Pergunta
(FMJ SP/2012)
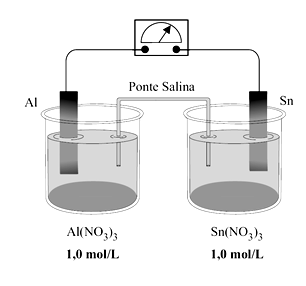
Uma célula eletroquímica foi construída para estudar o processo espontâneo de transferência de elétrons.

Potencial de redução a 25 ºC
Al3+(aq) + 3e → Al(s) – 1,66 V
Sn2+(aq) + 2e → Sn(s) – 0,14 V
A pilha em questão apresenta
Correto
Parabéns! Siga para a próxima questão.
Incorreto
Resposta incorreta. Revise o conteúdo nesta aula sobre eletroquímica para acertar na hora da prova!