"Na natureza nada se perde, nada se cria. Tudo se transforma." Você se lembra desta frase clássica deAntoine Lavoisier? Nesta aula vamos falar de onde veio este Postulado da Ciência, e também vamos explicar as Leis Ponderais de Proust. É Química para o Enem & o Encceja. Vem!
Você já deve ter ouvido a frase: “Na natureza nada se perde, nada se cria, tudo se transforma!”, você sabe o que ela realmente significa? Que tal descobrir isso e muito mais revisando sobre as leis Ponderais? Então não deixe essa chance passar, estude com o Blog do Enem!
No final do século XVIII, os cientistas Antoine Laurent Lavoisier e Joseph Louis Proust, através de estudos experimentais, concluíram que as reações químicas obedecem a determinadas leis. Essas leis são chamadas de leis ponderais e relacionam as massas das substâncias, reagentes e produtos participantes de uma reação química.
As Leis Ponderais foram postuladas no século XVIII, sendo essenciais para os estudos da estequiometria e de outras teorias que foram postuladas posteriormente. Agora vamos relembrar o que fala as principais Leis Ponderais?
Lei de Conservação das Massas ou Lei de Lavoisier: Figura 1. Químico francês Antoine Laurent Lavoisier “pai da química”. (1743-1794)
Figura 1. Químico francês Antoine Laurent Lavoisier “pai da química”. (1743-1794)
Lavoisier, depois de observar os resultados da experiência da calcinação do mercúrio metálico, concluiu que: “Em um sistema fechado, a massa total dos reagentes é igual à massa total dos produtos”.
Esta constatação pioneira entrou para a história da ciência, e ficou popularmente conhecida como o Postulado de Lavoisier:
“Na natureza nada se cria, nada se perde; tudo se transforma”.
Antes de ver alguns exemplos, que tal ver a explicação do prof. Sobis sobre a Lei de Lavoisier e Proust?
- Veja aqui os exemplos clássicos dessa lei de Lavoisier:
- Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água;
- H2 (g) +1/2 O2 (g) → H2O (l)
- 2 g + 16 g → 18 g
- Outro exemplo clássico:
- Quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre à formação de 44 gramas de gás carbônico.
- C(grafite) + O2(g) → CO2(g)
- 12 g + 32 g → 44 g
Lei das proporções constantes ou lei de Proust  Figura 2. Químico e farmacêutico Joseph Louis Proust (1754-1826). A Lei de Proust é conhecida como Lei das Proporções Constantes, e ssa lei das proporções constantes tem como enunciado:
Figura 2. Químico e farmacêutico Joseph Louis Proust (1754-1826). A Lei de Proust é conhecida como Lei das Proporções Constantes, e ssa lei das proporções constantes tem como enunciado:
Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.
Proust, por meio de uma série de experimentos constatou que as massas dos elementos envolvidos nas reações químicas são proporcionais. Ou seja, determinadas substâncias sempre reagem com outras a partir de uma proporção definida das massas envolvidas.
- Vejamos um exemplo:
- Carbono + Oxigênio → Gás Carbônico
- 3 g + 8g → 11 g
- Ou 6g + 16g → 22 g
- Ou 9g + 24g → 33g
Observe que as massas dos elementos envolvidos podem se alterar, no entanto, a proporção entre elas será sempre a mesma. Assim, se a massa de um elemento da reação química é duplicada, os outros também são. Isso explica o processo de balanceamento das reações químicas e os cálculos estequiométricos.
Dica 2 – Reveja também outro assunto bastante cobrado nas provas do Enem e dos vestibulares que é Solubilidade dos compostos orgânicos. Acesse o nosso blog do Enem e confira. Vai ficar de fora dessa?
Você consegue resolver este exercício sobre as leis ponderais? Então resolva e coloque um comentário no post, logo abaixo, explicando o seu raciocínio e apontando a alternativa correta para questão. Quem compartilha a resolução de um exercício ganha em dobro: ensina e aprende ao mesmo tempo. Ensinar é uma das melhores formas de aprender!
Observe a seguir uma tabela que relaciona certos dados obtidos em algumas reações de síntese realizadas em laboratório sem excessos de reagentes:
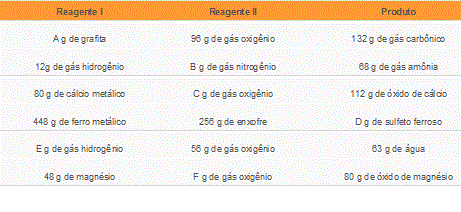
Com base na lei de Lavoisier, indique os valores das massas que substituiriam corretamente as letras A, B, C, D, E e F nessas reações:
a) 120 g, 56 g, 32 g, 500 g, 63 g, 23 g.
b) 36 g, 80 g, 71 g, 448 g, 56 g, 42 g.
c) 36 g, 56 g, 32 g, 704 g, 7 g, 32 g.
d) 36 g, 56 g, 32 g, 704 g, 7 g, 42 g.
e) 228 g, 80 g, 192 g, 704 g, 119 g, 128 g.
Resposta: C


